XLH로 진단되는 환자에 최대한 빨리 크리스비타로
치료를 시작해야 합니다.
Table of Contents
2020년 9월, 크리스비타는 식약처로부터 FGF23 관련 저인산혈증 구루병 및 골연화증에 허가를 받았습니다.1 크리스비타를 투여하기 전에 자세한 사항은 제품설명서를 참고하시기 바랍니다.
크리스비타는 유럽, 미국, 일본 및 한국을 포함한 아시아 몇몇 지역에서 허가를 받았습니다.
국가별로 허가받은
제품 정보는 다를 수 있습니다. 따라서 크리스비타를 투여하기 전에,
각국의 제품 허가 현황 및 제품정보를
확인하시기 바랍니다.
투여 용량
소아 FGF23 관련 저인산혈증성 구루병 및 골연화증(종양성골연화증 제외) 환자는 이 약을 2 주에 한 번씩 피하 투여합니다. 1
As of 3 May 2021, CRYSVITA has been approved by Health Science Authority (HSA) Singapore. To decide if this is a suitable option for any of your patients, please click here for more information.
Product is approved in EU/US/Japan and selected markets in Asia Pacific. Local approved prescribing information may differ.
Please refer to local approval status and prescribing information.
소아환자는 이 약 0.8 mg/kg 을 2 주에 한 번씩 피하 투여합니다.
혈청 인 농도와 증상에 따라 필요 시 투여량을 증감할 수 있으며, 1회 최대 용량은 2mg/kg이여야 하고, 1 회 투여량은 90 mg 을 초과해서는 안됩니다.
이 약의 투여 시작 용량과 용량 조정은 다음의 표를 참고하여 결정해야 합니다. (제품설명서에서 표를 확인하시기 바랍니다.) 이 약의 투여 용량은 체중에서 환산한 값을 10 mg 단위로 반올림하여 결정할 수 있습니다.
이 약의 투여를 시작하고 용량 조절 시에 혈청 인 농도가 안정될 때까지 매 투여 시마다 2 주 혹은 4 주에 한 번씩 혈청 인 농도를 측정해야 합니다.
이 약을 FGF23 관련 저인산혈증성 구루병 환자에게 투여할 때, 골 연령이 남성은 만 17 세, 여성은 만 15 세에 도달하면 환자의 상태에 따라서 성인과 동일한 투여 용량을 적용해야 합니다.
경구 인산 제제 또는 활성형 비타민 D3 제제를 투여하고 있는 경우, 이 약의 투여를 시작하기 1 주일 전에는 이들 약물의 투여를 중단하고, 혈청 인 농도가 기준 하한값 이하로 떨어짐을 확인한 다음에 이 약의 투여를 시작해야 합니다.
성인 FGF23 관련 저인산혈증성 구루병 및 골연화증 또는 종양성골연화증 환자는 이 약 1mg/kg 을 4 주에 한 번씩 피하 투여합니다.1
1. FGF23 관련 저인산혈증성 구루병 및 골연화증 (종양성골연화증 제외)
1 회 투여량은 90 mg 을 초과해서는 안 되고, 혈청 인 농도와 증상에 따라 필요 시 투여량을 줄일 수 있습니다.
이 약의 투여 시작 용량과 용량 조정은 다음의 표를 참고하여 결정해야 합니다. (제품설명서에서 표를 확인하시기 바랍니다.) 이 약의 투여 용량은 체중에서 환산한 값을 10 mg 단위로 반올림하여 결정할 수 있습니다.
이 약의 투여를 시작하고 용량 조절 시에 혈청 인 농도가 안정될 때까지 매 투여 시마다 2 주 혹은 4 주에 한 번씩 혈청 인 농도를 측정해야 합니다.
이 약을 FGF23 관련 저인산혈증성 구루병 환자에게 투여할 때, 골 연령이 남성은 만 17 세, 여성은 만 15 세에 도달하면 환자의 상태에 따라서 성인과 동일한 투여 용량을 적용해야 합니다.
경구 인산 제제 또는 활성형 비타민 D3 제제를 투여하고 있는 경우, 이 약의 투여를 시작하기 1 주일 전에는 이들 약물의 투여를 중단하고, 혈청 인 농도가 기준 하한값 이하로 떨어짐을 확인한 다음에 이 약의 투여를 시작해야 합니다.
2. 종양성골연화증
혈청 인 농도와 증상에 따라 필요 시 투여량을 증감할 수 있으며, 1 회 최대 용량은 2 mg/kg 이어야 합니다.
이 약의 투여 시작 용량과 용량 조정은 다음의 표를 참고하여 결정해야 합니다. (제품설명서에서 표를 확인하시기 바랍니다.) 이 약의 투여 용량은 체중에서 환산한 값을 10 mg 단위로 반올림하여 결정할 수 있습니다.
이 약의 투여를 시작하고 용량 조절 시에 혈청 인 농도가 안정될 때까지 매 투여 시마다 2 주 혹은 4 주에 한 번씩 혈청 인 농도를 측정해야 합니다.
경구 인산 제제 또는 활성형 비타민 D3 제제를 투여하고 있는 경우, 이 약의 투여를 시작하기 1 주일 전에는 이들 약물의 투여를 중단하고, 혈청 인 농도가 기준 하한값 이하로 떨어짐을 확인한 다음에 이 약의 투여를 시작해야 합니다.
시작 투여량 계산 예시
시작 투여량 계산 예시
체중 (kg) x 권장 시작 투여량 (0.8mg/kg)
예시 : 23kg X 0.8mg/kg = 18.4mg (10mg 단위로 반올림)
크리스비타 시작 투여 용량 = 20mg (1회 최대 투여량 2mg/kg)
시작 투여량 계산 예시 – 성인 XLH 환자
체중 (kg) x 권장 시작 투여량 (1.0mg/kg)
크리스비타 시작 예시 : 72kg X 1.0mg/kg = 72mg (10mg 단위로 반올림)
투여 용량 = 70mg (1회 최대 투여량 90mg)
시작 투여량 계산 예시 – 성인 TIO 환자
체중 (kg) x 권장 시작 투여량 (0.3mg/kg)
예시 : 72kg X 0.3mg/kg = 21.6mg (10mg 단위로 반올림)
크리스비타 시작 투여 용량 = 20mg (1회 최대 투여량 2mg/kg)
소아 XLH 환자 투여 정보1
용량 증가 (Dose Increase)
일반적으로 소아에서는 환자의 체중에 따라 다음 표를 참고하여 투여를 시작합니다. 이후 혈청인 농도와 증상에 따라 적절히 증량 또는 감량합니다.
예를 들어 혈청 인 농도가 기준 하한값 이하로 떨어질 때와 같이 증량이 필요한 경우, 단계적으로 용량을 증가시키되 최대 용량은 1 회 2 mg/kg 또는 90 mg 중 적은 양이어야 합니다. 단, 증량 시에는 4 주 이상의 간격을 두어야 합니다.
이 약의 투여를 시작하고 용량 조절 시에 혈청 인 농도가 안정될 때까지 매 투여 시마다 2 주 혹은 4 주에 한 번씩 혈청 인 농도를 측정해야 합니다.
FGF23 관련 저인산혈증성 구루병 및 골연화증 (종양성골연화증 제외) 소아 환자의 시작 용량
| 체중 (kg) | 권장 시작 투여량 (mg) |
|---|---|
| 7-18 | 10 |
| 19-31 | 20 |
| 32-43 | 30 |
| 44-56 | 40 |
| 57-68 | 50 |
| 69-81 | 60 |
| 82-93 | 70 |
| 94-106 | 80 |
| ≥ 107 | 90 |
Dose decrease (pediatric patients 1 to less than 18 years of age)1
용량 감소(Dose Decrease)
일반적으로 소아에서는 환자의 체중에 따라 다음 표를 참고하여 투여를 시작합니다. 이후 혈청인 농도와 증상에 따라 적절히 증량 또는 감량합니다.
혈청 인 농도가 기준 상한값 이상으로 증가하면 하한값 이하가 될 때까지 이 약 투여를 중단해야 합니다. 투여 재개를 위해서는 투여 중단 전 용량의 약 절반으로 줄여서 투여를 재시작 합니다. 투여 재개를 위해서는 투여 중단 전 용량의 약 절반으로 줄여서 투여를 재시작 합니다.
성인 XLH 환자 투여 정보1
FGF 23 관련 저인산혈증성 구루병 및 골연화증 (성인)
용량 감소(Dose Decrease)
일반적으로 성인에서 환자의 체중에 따라 다음 표를 참고하여 투여를 시작합니다. 이후 혈청인 농도 및 증상에 따라 적절히 감량합니다.
혈청 인 농도가 기준 상한값 이상으로 증가하면 하한값 이하가 될 때까지 이 약 투여를 중단해야 합니다. 투여 재개를 위해서는 투여 중단 전 용량의 약 절반으로 줄여서 투여를 재시작 합니다. 투여 재개를 위해서는 투여 중단 전 용량의 약 절반으로 줄여서 투여를 재시작 합니다.
FGF23 관련 저인산혈증성 구루병 및 골연화증 (종양성골연화증 제외) 성인 환자의 시작 용량
| 체중 | 시작 투여량 |
|---|---|
| 35 - 44 kg | 40 mg |
| 45 - 54 kg | 50 mg |
| 55 - 64 kg | 60 mg |
| 65 - 74 kg | 70 mg |
| 75 - 84 kg | 80 mg |
| ≥ 85kg | 90 mg |
종양성 골연화증
용량 증가 & 감소(Dose Increase & Decrease)
일반적으로 환자의 체중에 따라 다음 표를 참고하여 투여를 시작합니다. 이후 혈청인 농도와 증상에 따라 적절히 증량 또는 감량합니다. 예를 들어 혈청 인 농도가 기준 하한값 이하로 떨어질 때와 같이 증량이 필요한 경우, 단계적으로 용량을 증가시키되 최대 용량은 1 회 2mg/kg 이어야 합니다.
이 약의 투여를 시작하고 용량 조절 시에 혈청 인 농도가 안정될 때까지 매 투여 시마다 2 주 혹은 4 주에 한 번씩 혈청 인 농도를 측정해야 합니다.
혈청 인 농도가 기준 상한값 이상으로 증가하면 하한값 이하가 될 때까지 이 약 투여를 중단해야 합니다. 투여 재개를 위해서는 투여 중단 전 용량의 약 절반으로 줄여서 투여를 재시작 합니다. 투여 재개를 위해서는 투여 중단 전 용량의 약 절반으로 줄여서 투여를 재시작 합니다.
종양성골연화증 환자의 시작 용량
| 체중 | 시작 투여량 |
|---|---|
| 17 - 49 kg | 10 mg |
| 50 - 83 kg | 20 mg |
| 84 - 116 kg | 30 mg |
투여 방법
크리스비타 투여 방법1
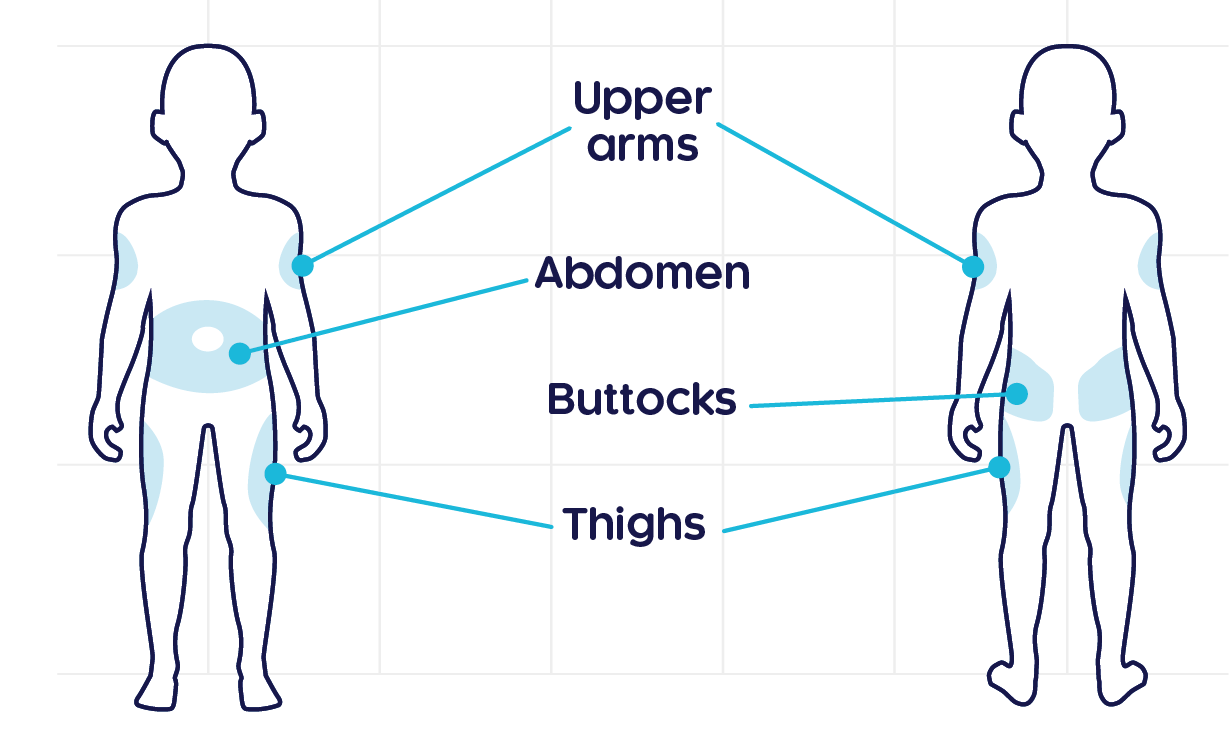
크리스비타는 피하로 투여합니다1
경구 인산 제제 또는 활성형 비타민 D3 제제를 투여하고 있는 경우, 이 약의 투여를 시작하기 1 주일 전에는 이들 약물의 투여를 중단하고, 혈청 인 농도가 기준 하한값 이하로 떨어짐을 확인한 다음에 이 약의 투여를 시작해야 합니다.
투여 시 주의사항
- 주사 부위에 회당 최대 주사량은 1.5 mL 입니다.
- 이 약은 1 회용이며, 남은 약액은 다시 사용하지 않습니다
이 약의 투여는 의료기관에서 의사에 의해 또는 의사의 직접적인 감독하에 시작되어야 합니다. 이 약의 자가투여 시에는 아래의 주의사항을 준수해야 합니다.
- 의사는 신중히 자가 투여 적용의 타당성(즉각적인 용량 변경이 필요 없는 경우 등)을 검토하며, 환자 또는 보호자에게 필요한 교육 및 훈련을 제공해야 합니다. 또한 자가 투여를 허용하기 전에 환자 또는 보호자가 의사의 관리 및 지침에 따라 확실히 약을 자가 투여할 수 있는지 확인해야 합니다.
- 자가 투여 중에도 혈청 인 농도의 측정을 포함한 환자의 모니터링을 충분히 해야 합니다.
- 또한 이 약의 투여 후 약물이상반응이 의심되거나 자가 투여를 지속하기 어려울 경우에는 즉시 중단하며, 의사의 관리하에 모니터링과 같은 적절한 조치를 취해야 합니다.
- 환자 또는 보호자는 약물이상반응과 그 대처 방법에 설명을 받아야 합니다. 어떠한 약물이상 반응이 의심되는 경우에는 의료 기관에 연락하도록 안내받아야 합니다.
- 환자 또는 보호자는 사용한 주사기를 재사용하지 않고, 안전하게 폐기하는 방법에 대해서 확실히 인지해야 합니다.
모니터링
크리스비타 투여 환자에 대한 권고 모니터링® 항목2
| 평가 항목 | 모니터링 빈도 |
|---|---|
| 공복 혈청 인산염 (Fasting serum phosphate)† | 투여 1개월 : 2주마다 |
| 투여 2~3개월 : 4주마다 | |
| 투여 3개월 이후 : 적절한 시기마다 | |
| 용량 조절 이후 : 4주 후 | |
| 신장 초음파 |
신석회화가 없는 경우 : 최소 2년마다 신석회화 및/또는 지속적인 고칼슘뇨증이 있는 경우 : 1년마다
|
| 혈장 ALP, 칼슘, PTH, 크레아티닌 (Plasma ALP, calcium, PTH and creatinine) | 1-5세 소아 환자 : 1~3개월마다 또는 as indicated |
| 5-12세 소아 환자 : 3~6개월마다 또는 as indicated | |
| 소변 칼슘 : 크레아티닌 비율‡ | 3~6개월마다 |
†공복 혈청 인산염은 연령별 정상 범위의 하한치를 목표로 하는 것이 좋습니다.
‡정상 상한 범위(mol/mol) : 2.2 (7 years).
금기사항 및 사용상의 주의사항1
금기사항
Do not administer to the following patients
- 인산(phosphorus) 제제 또는 활성 비타민 D3 제제를 경구 투여하는 환자
- 중증의 신장 손상 또는 말기 신부전증이 있는 환자. 고인산혈증 및 신장과 같은 기관에 석회화가 발생할 위험이 높습니다. 이 환자 집단에서는 임상시험이 수행되지 않았습니다.
- 이전에 이 약의 성분에 대한 과민성이 있는 환자
- 사카레이티드산화철(saccharated iron oxide)과 폴리말토오스철(polymaltose iron)의 투여와 관련된 FGF23 관련 저인산혈증성 구루병 및 골연화증 환자. 과도한 FGF23 의 생산을 유발할 수 있는 약물의 치료 중단을 고려해야 합니다
신중투여
The following patients should be administered with care
- 아래의 질병에 대한 이력이나 합병증이 있는 환자
- 고칼슘혈증 환자 : 고칼슘혈증이 악화될 수 있습니다.
- 중등증 또는 경증의 신부전증 환자
이 약의 투여 중에는 정기적으로 신장 기능을 확인하여, 투여의 적절성을 검토해야 합니다. 또한 혈청인 농도의 변화를 주의하여 관찰해야 합니다.
임부, 수유부, 가임 여성에 대한 투여
- 임신 또는 임신이 의심되는 여성에게는 이 약의 치료 상의 이익이 예상되는 위험성보다 크다고 생각되는 경우에만 투여해야 합니다. 원숭이를 이용한 생식 및 발달 독성 연구 결과, 임상 최대 노출 용량의 3.7 배에 해당하는 용량에서 조기 분만율의 증가, 임상 최대 노출 용량의 32 배에 해당하는 용량에서 태반의 무게와 미네랄 축적의 증가, 유산율 및 배태아 사망률의 증가가 확인되었습니다.
- 모유 수유의 지속 또는 중단은 이 약의 치료 상의 이익과 모유 수유의 이익을 고려하여 판단하여야 합니다. 이 약이 모유로 이행되는지에 대해서는 아직 밝혀지지 않았습니다.
저장방법
크리스비타 저장방법1
약품 준비 시 주의사항
- 이 약은 사용 전에 냉장고에서 꺼내어 실온 상태로 만듭니다.
- 정확한 양의 약물 투여를 위해 적절한 규격의 작은 주사기를 선택합니다.
- 주사 시 다른 약물과 섞지 않습니다.
보관 및 취급상의 주의사항
- 사용할 때까지 냉장 조건에 원포장을 유지하여 차광하여 보관해야 합니다.
- 동결하거나 흔들지 않습니다. 얼리거나 흔들지 않습니다.
- 어린이의 손이 닿지 않는 곳에 보관합니다.
- 상자를 개봉한 이후에는 차광하여 보관합니다.
- 보관 시 혼동이 일어나지 않도록 다른 용기에 바꾸어 넣지 않습니다.
저장방법
- 밀봉용기, 2~8℃에서 차광하여 냉장 보관합니다.
- 외부 포장에 기재된 사용기간이 지나면 사용하지 않습니다.
투여하기 전에 크리스비타 제품설명서를 확인하시기 바랍니다.
1. CRYSVITA® (burosumab). Based on Korean Insert paper. Kyowa Kirin Asia Pacific Pte Ltd; May 2021 2. Haffner D et al. Nat Rev Nephrol. 2019; 15(7): 435–455.






