크리스비타는 성인 XLH 환자의 인산염 레벨, 골연화증 평가척도, 통증,
경직 및 이동성의 유의한 개선 효과를 입증하였습니다.
Table of Contents
Phase III efficacy and safety
성인 XLH 환자를 대상으로 크리스비타의 유효성과 안전성은 3상 임상시험에서
연구되었습니다.
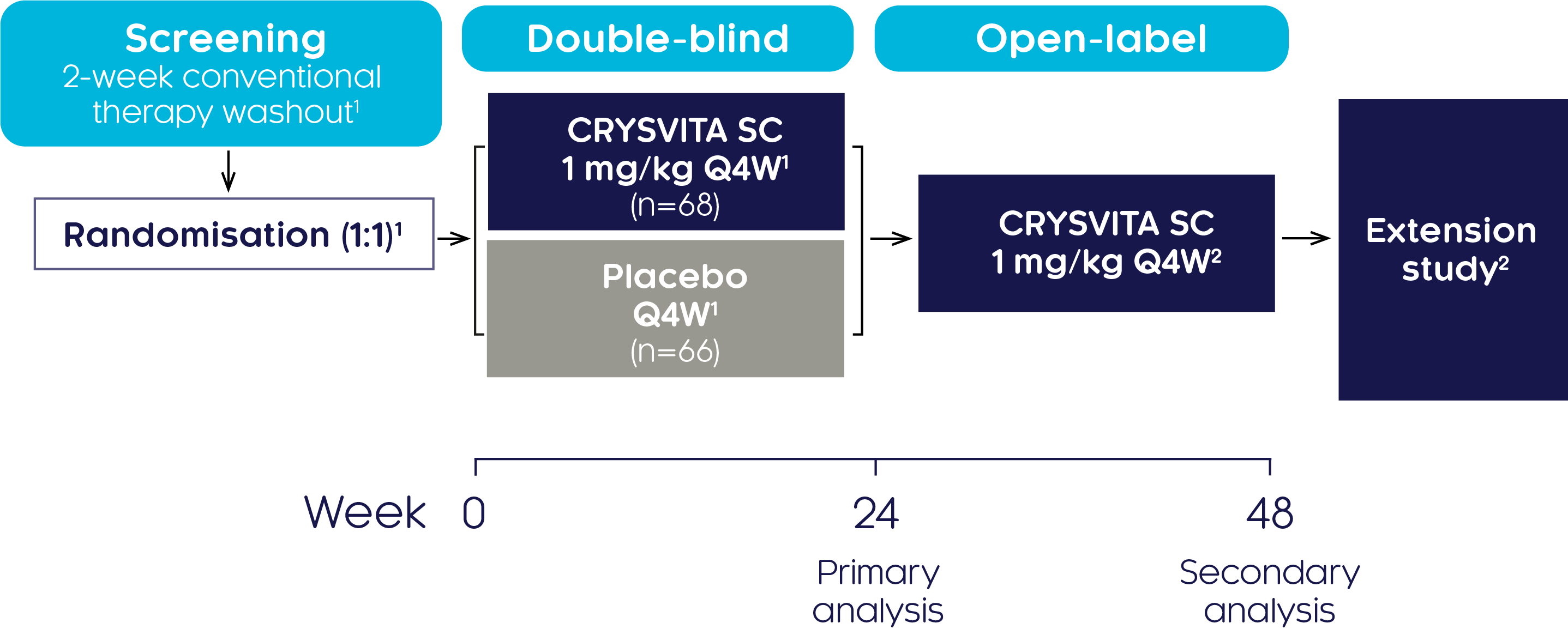
시험 디자인1,2
18-65세 성인 XLH 134명 환자에서 크리스비타의 유효성과 안전성을 연구하기 위해 전세계에 있는 25개 시험기관에서 무작위배정, 이중 눈가림, 위약 대조, 3상 임상시험을 수행하였습니다. 이중 눈가림, 위약 대조 기간은 24주였고, 이후 크리스비타로 24주간 지속 투여하였습니다.
| Study population (N=134):1 | |
|---|---|
| Aged 18 to 65 years | TmP/GFR <2.5 mg/dL |
| A diagnosis of XLH supported by a confirmed PHEX mutation) | BPI worst pain score ≥4 |
| Serum phosphate below the lower limit of normal (LLN), 2.5 mg/dL (0.81 mmol/L) | |
1차 평가변수1,2
- 베이스라인 후 제24주까지 투여 주기에 걸쳐 평균을 구했을 때, 투여 간격의 중간점에서 평균 혈청 인산염 농도가 ≥ LLN 2.5 mg/dL (0.81 mmol/L)를 나타낸 시험대상자 비율
2차 평가변수1,2
- 환자보고결과: 베이스라인 후 48주까지 BPI 최악 통증 점수 변화, 및 12주마다 평가한 경직 및 신체 기능에 대한 WOMAC 점수
- 베이스라인 후 48주까지 생화학적 표지자 변화: TmP/GFR 및 1,25(OH)2D
- 베이스라인 후 48주까지 골 재형성 표지자 변화: P1NP, CTx 및 BALP
탐색적 평가변수 (12주마다 평가함)1,2
- 베이스라인 후 48주까지 활동성 가성골절 또는 골절 수 변화
- 베이스라인 후 48주까지 6MWT에서 총 보행거리 변화
Safety Endpoints1,2
- 이상사례 및 중대한 이상사례 발생률
베이스라인에서 환자 특성2
| Characteristic |
Placebo → CRYSVITA® (n=66) |
CRYSVITA® → CRYSVITA® (n=68) |
|---|---|---|
| Mean age, years (SD) | 38.7 (12.8) | 41.3 (11.6) |
| Female, n (%) | 43 (65.2) | 44 (64.7) |
| WOMAC stiffness†, mean (SD) | 61.4 (20.8) | 64.7 (20.3) |
| WOMAC physical function†, mean (SD) | 43.9 (19.9) | 50.8 (19.7) |
| BPI worst pain‡, mean (SD) | 6.5 (1.4) | 6.8 (1.3) |
| TmP/GFR§, mg/dL, mean (SD) | 1.6 (0.37) | 1.7 (0.40) |
| Serum phosphate§, mg/dL, mean (SD) | 1.9 (0.32) | 2.0 (0.30) |
| Serum 1,25(OH)2D§, pg/mL, mean (SD) | 33.5 (15.6) | 32.4 (13.0) |
| Enthesopathy on X-ray, n (%) | 65 (98.5) | 68 (100.0) |
| Unhealed fracture/pseudofracture, n (%) of participants | 38 (57.6) | 32 (47.1) |
| No. of fractures/pseudofractures | 91 | 65 |
| Fractures | 13 | 14 |
| Pseudofractures | 78 | 51 |
†0 (최상의 건강 상태)부터 100 (최악의 건강 상태) 범위의 정규화한 척도 사용. ‡0 (통증 없음)부터 10 (최악의 통증) 범위의 척도 사용. §정상범위: TmP/GFR, 2.5–4.2 mg/dL; 인산염, 2.5–4.5 mg/dL; 1,25(OH)2D, 18–72 pg/mL.11
Phosphate regulation (CRYSVITA® vs placebo)
크리스비타는 XLH가 있는 성인에서 인산염 항상성을 회복시킵니다.2
크리스비타는 1주차에 빠르게 LLN 이상의 평균 혈청 인산염 레벨을 달성하였고, 이는 위약과 비교하여 24주 동안 지속되었습니다. (p<0.001)2
Mean change in serum phosphate2
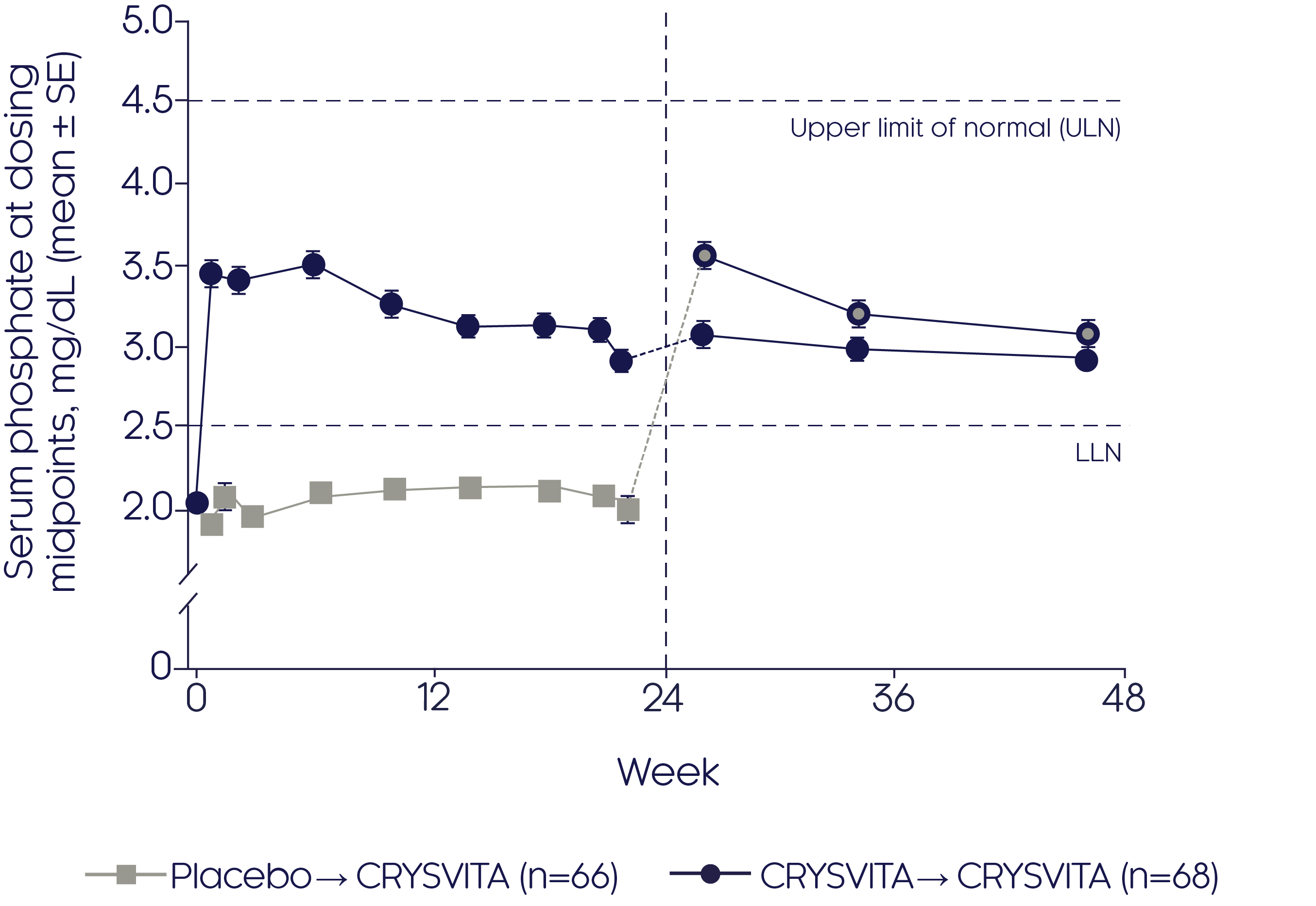
Adapted from Portale AA, et al, 20192
- 평균 혈청 인산염 개선은 크리스비타 치료군에24주차에 크리스비타로 투여 전환 후, 평균 혈청 인산염 농도가 즉각적으로 증가되었고, 24주 라벨 공개 치료 기간동안 LLN 이상으로 유지되었습니다. (p 값 NR)
- 위약 치료군에서 제24주에 시작한 크리스비타 치료 시, 평균 혈청 인산염 농도가 즉각적으로 증가되었고 24주 라벨 공개 치료 시작 기간 동안 LLN 이상으로 유지되었습니다 (p 값 NR)
크리스비타 치료 시 2주차에 빠르게 유의하게 (p<0.001) 더 우수한 TmP/GFR을 얻었고 위약과 비교하여 24주 동안 지속되었습니다.2
Mean change in TmP/GFR2

Adapted from Portale AA, et al, 20192
- TmP/GFR 개선은 크리스비타 치료군에서 24주 라벨 공개 치료 기간 동안 지속되었습니다 (p 값 NR)
- 위약 치료군에서 크리스비타 치료 시작 시, 베이스라인 후 24주 라벨 공개 치료 기간 종료까지 TmP/GFR 증가가 나타났습니다 (베이스라인으로부터 48주, p 값 NR)
크리스비타는 24주 동안 위약과 비교하여 혈청 1,25(OH)2 D를 유의하게 (p<0.001) 더 증가시켰습니다.2
Mean change in serum 1,25(OH)2 D2
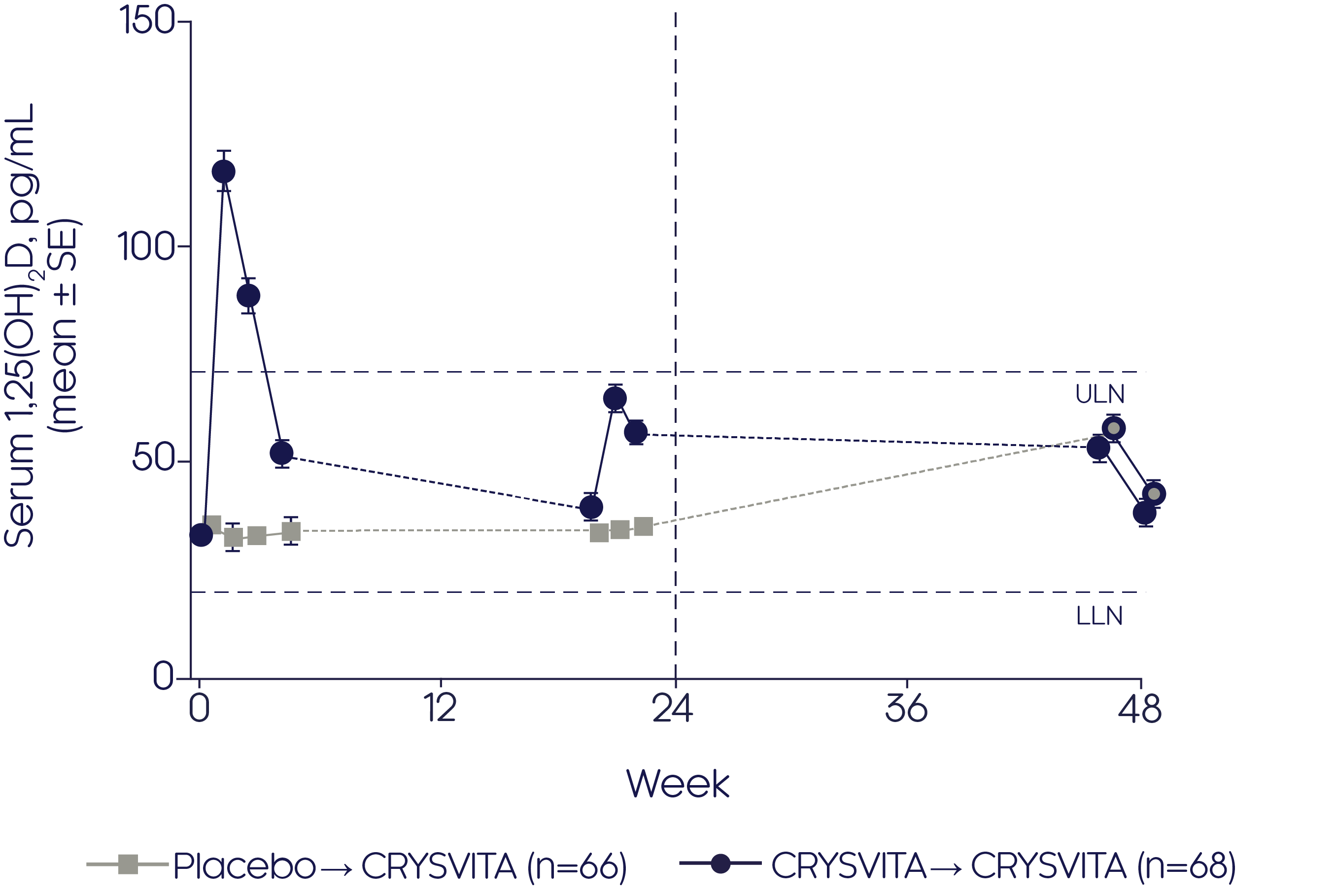
Adapted from Portale AA, et al, 20192
- 크리스비타® achieved an increase in 1,25(OH)2D from baseline to the end of the 24-week open-label continuation period (48 weeks from baseline) in the CRYSVITA® group (p value not reported)
- Initiation of CRYSVITA® treatment in the placebo group showed an increase in 1,25(OH)2D from baseline to the end of the 24-week open-label continuation period (48 weeks from baseline, p value not reported)
Pain, stiffness, physical function and mobility
크리스비타는 XLH가 있는 성인에서 통증, 경직, 기능적 장애 및 이동성을 개선합니다.2
크리스비타는 크리스비타-크리스비타 치료군에서 베이스라인부터 48주까지 BPI 최악 통증 점수를 유의하게 (p<0.001) 개선하였습니다.2
Mean change in BPI worst pain score2

Adapted from Portale AA, et al, 20192
- 크리스비타는 크리스비타-크리스비타 치료군에서 베이스라인부터 제48주까지 BPI 최악 통증 점수를 유의하게 (p<0.001)
개선하였습니다2
*베이스라인부터 제48주까지 최소 제곱(LS) 평균 변화에 대해 p<0.001 (크리스비타 → 크리스비타), **제24주부터 제48주까지 LS 평균 변화에 대해 p<0.001 (위약 → 크리스비타).
크리스비타는 위약과 비교하여 24주에 WOMAC 경직 점수를 유의하게 (p<0.001) 감소시켰습니다.1
Mean change in WOMAC stiffness score2
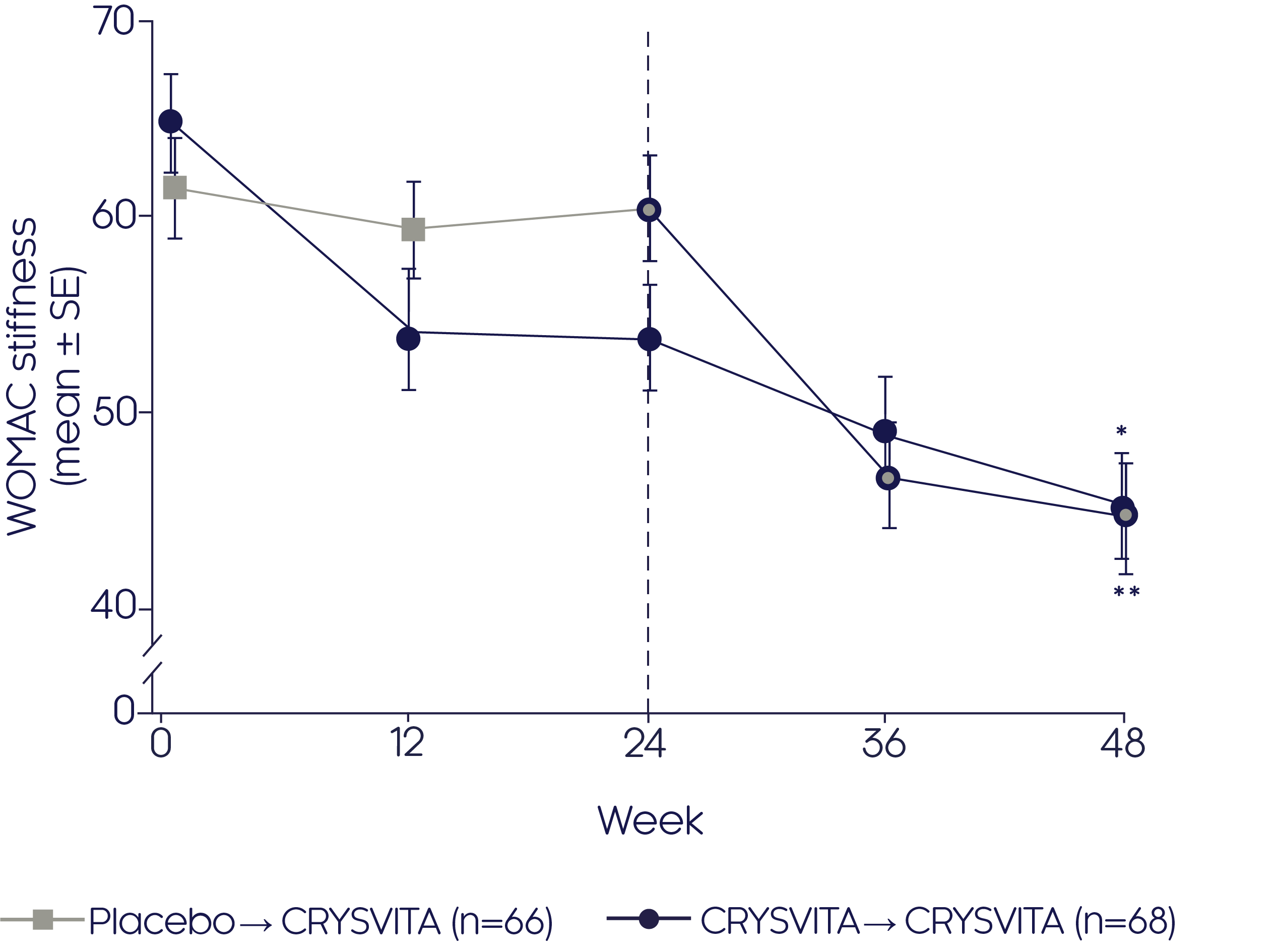
Adapted from Portale AA, et al, 20192
- 유의한(p<0.001) 개선은 크리스비타-크리스비타 치료군에서 베이스라인 이후부터 48주까지 확인되었습니다2
- 또한, 크리스비타는 24주부터 48주까지 위약에서 크리스비타로 전환한 환자에서 확인된 WOMAC 점수에 따라 경직을 유의하게 (p<0.0001) 개선하였습니다2
*베이스라인 이후부터 48주까지 LS 평균 변화에 대해 p<0.001 (크리스비타 → 크리스비타), **24주부터 48주까지 LS 평균 변화에 대해 p<0.001 (위약 → 크리스비타).
크리스비타는 크리스비타-크리스비타 치료군에서 베이스라인 이후부터 48주까지 WOMAC 신체 기능 손상 점수를 유의하게 (p<0.001) 개선하였습니다.2
Mean change in WOMAC physical function score2

Adapted from Portale AA, et al, 20192
*베이스라인 이후부터 48주까지 LS 평균 변화에 대해 p<0.001 (크리스비타 → 크리스비타), **24주부터 48주까지 LS 평균 변화에 대해 p<0.001 (위약 → 크리스비타).
크리스비타는 크리스비타-크리스비타 치료군에서 베이스라인 이후부터 48주까지 기능적 운동 능력 증가(6MWT 평가)로 확인된 바와 같이, 이동성을 유의하게 (p<0.001) 개선하였습니다.2
Mean change in total distance walked in 6MWT2

Adapted from Portale AA, et al, 20192
- 또한, 크리스비타는 24주부터 48주까지 위약에서 크리스비타로 전환한 환자들에서 기능적 운동 능력 증가(6MWT로 평가함)로 확인된 바와 같이, 이동성을 유의하게 (p<0.001) 개선하였습니다 2
*베이스라인 이후부터 48주까지 LS 평균 변화에 대해 p<0.001 (크리스비타 → 크리스비타), **24주부터 48주까지 LS 평균 변화에 대해 p<0.001 (위약 → 크리스비타).
Fractures and pseudofractures
골절/가성골절은 XLH가 있는 성인에서 크리스비타 치료 시 보다 빠르게 치유됩니다.
크리스비타로 치료받은 XLH가 있는 성인에서, 베이스라인에서 활동성 골절 및 가성골절의 63%가 48주에 완전히 치유되었습니다 (p 값 NR).2
Proportion of baseline active fractures and pseudofractures fully healed2

Pseudofracture healing in a 38-year-old woman treated with 크리스비타®1

Bone remodelling
크리스비타는 골 재형성의 주요 표지자를 개선하였습니다.2
- 제48주에, 크리스비타는 골 재형성 표지자(P1NP 및 CTx [p<0.05]와 BALP [p=ns])에 대해 베이스라인으로부터 개선 효과를 나타냈습니다2
| Bone remodelling marker | Placebo → CRYSVITA® group2 | CRYSVITA® → CRYSVITA® group2 |
|---|---|---|
| P1NP, LS mean (95% CI) | 76.9 ng/mL (54.9, 98.9) | 35.7 ng/mL (17.5, 53.9) |
| CTx, LS mean (95% CI) |
295.9 pg/mL (200.8, 391.1) |
127.1 pg/mL (36.7, 217.5) |
| BALP, LS mean (95% CI) |
6.7 μg/L (2.6, 10.7) |
1.2 μg/L (−2.3, 4.8) |
- 크리스비타 → 크리스비타 치료군에서, 3개의 지표에서 최대 증가가 베이스라인 후 첫 측정값에서 확인되었고, 이후 48주 동안 크리스비타 효과는 약화되고 안정화되었습니다2
Safety (24 and 48 Weeks)
크리스비타는 XLH가 있는 성인에서 내약성이 우수하였고 최대 48주까지 허용되는 안전성 프로파일을 나타냈습니다.2
- 크리스비타 치료군에서 이상사례는 발생률, 특징 및 중증도 측면에서 위약과 비슷하였습니다2
- 이상사례는 대부분 중증도가 경증 내지 중등증이었습니다2
- 고인산혈증이 크리스비타 치료 중 시험대상자의 7%에서 관찰되었으나, 임상적 발현증상은 없었고 용량을 감량한 후 소실되었습니다2
| Double-blind treatment period2 |
Any exposure to 크리스비타®2 |
|||
|---|---|---|---|---|
| Patient incidence of AEs, n (%) |
Placebo n=66 Weeks 0–24 |
크리스비타® n=68 Weeks 0–24 |
Placebo → 크리스비타® n=66 Weeks 24–cutoff |
크리스비타® → 크리스비타® n=68 Weeks 0–cutoff |
| Any TEAE | 61 (92.4) | 64 (94.1) | 63 (95.5) | 68 (100) |
| Related TEAE† | 26 (39.4) | 30 (44.1) | 32 (48.5) | 42 (61.8) |
| Serious TEAE | 2 (3.0) | 2 (2.9) | 8 (12.1) | 7 (10.3) |
| Grade 3 or 4 TEAE | 9 (13.6) | 8 (11.8) | 14 (21.2) | 15 (22.1) |
| Related serious TEAE† | 0 | 0 | 0 | 0 |
| TEAE led to study discontinuation | 0 | 0 | 0 | 0 |
| TEAE led to treatment discontinuation | 0 | 0 | 0 | 0 |
| TEAE led to death | 0 | 0 | 0 | 0 |
††환자들은 출판물에 기재되지 않은 자료마감일까지 모니터링하였습니다.
Phase III bone histomorphometric measures of osteomalacia
3상 임상시험
성인 XLH 환자의 골연화증 개선에 대한 크리스비타의 유효성과 안전성을 3상 임상시험에서 연구하였습니다.3
시험 디자인3
등록 전에 최소 2년 이상 치료받은 적이 없는 성인 XLH 환자의 골연화증 개선 측면에서 크리스비타의 유효성과 안전성을 조사하기 위해 라벨 공개, 단일군, 다기관, 다국가, 3상 임상시험을 수행하였습니다. 시험대상자는 최소 96주 동안 4주마다(Q4W) 크리스비타 치료를 받았습니다.
| Study population (N=14):3 | |
|---|---|
| Aged 18 to 65 years | TmP/GFR <2.5 mg/dL |
| A diagnosis of XLH supported by a confirmed PHEX mutation or serum intact FGF23 level >30 pg/mL | BPI worst pain score ≥4 |
| Serum phosphate <2.5 mg/dL | No conventional therapy in the past 2 years |
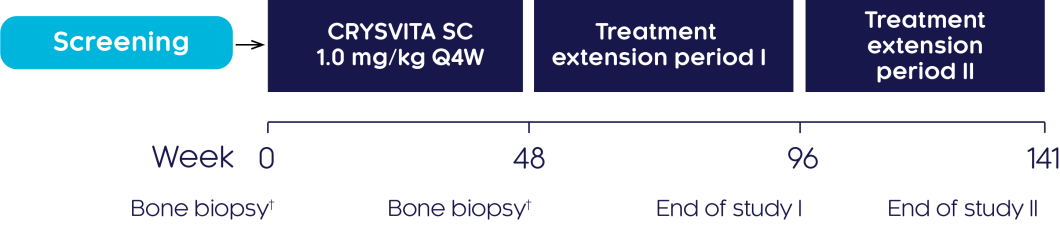
††장골능 관통 골생검 검체(transiliac crest bone biopsies) (전상장골극(anterior superior iliac spine)의 배측 2 cm 부위에서 장골에 대한 수평 전층 생검 검체)는 베이스라인 및 48주에 채취하였습니다.3
1차 평가변수3
- 베이스라인 이후부터 48주까지 장골능 관통 골생검 분석 결과에 근거한 유골 부피/뼈 부피 비 변화율
2차 평가변수3
- 베이스라인 이후부터 24주까지 투여 주기 동안 평균을 구한, 투여 간격 중간점에서 평균 인산염 레벨이 LLN (2.5 mg/dL) 이상인 환자 비율
- 베이스라인부터 48주까지 유골 두께, 유골 표면/골표면 비 및 무기질화 지체시간의 변화율
- 베이스라인부터 TmP/GFR 및 혈청 1,25(OH)2D 레벨의 시간 경과에 따른 변화
- 베이스라인부터 P1NP, CTx 및 BALP를 포함하여 골 재형성의 혈청 생화학적 지표의 시간 경과에 따른 변화 및 변화율
- 베이스라인부터 동적 재형성 파라미터의 시간 경과에 따른 변화: 무기질 침착률, 무기질화 표면/골표면(MS/BS) 비와 무기질화 표면/유골 표면 (MS/OS)
탐색적 평가변수3
- 베이스라인에서 골격 검사 결과와 이후 표적화된 방사선학적 평가 결과로부터 정의된 활동성 골절 및/또는 가성골절의 치유
- BPI 및 BFI에 근거한 통증 및 피로의 베이스라인 이후부터 48주까지 변화
안전성 평가변수3
- AEs 및 중대한 AEs의 발생률과 중증도, 항-크리스비타 항체 생성, ECHO 및 ECG 변화, 신장 초음파검사 신석회화증 점수, 공복 혈청 칼슘, 혈장 iPTH 및 24시간 소변 칼슘 배설
베이스라인에서 환자 특성3
| Characteristic | Total (N=14) |
|---|---|
| Mean age, years (SD) | 40.1 (8.7) |
| Female, n (%) | 8 (57.1) |
| Race, n (%) | |
| Asian | 4 (28.6) |
| Black or African American | 1 (7.1) |
| White | 9 (64.3) |
| 체중, kg, mean (SD) | 70.3 (22.0) |
| Height, cm, mean (SD) | 150.4 (9.0) |
| Body mass index, kg/m2, mean (SD) | 30.8 (8.5) |
| Serum phosphate, mg/dL, mean (SD)† | 2.2 (0.4) |
| TmP/GFR, mg/dL, mean (SD)† | 1.9 (0.3) |
| Serum 1,25(OH)2D, pg/mL, mean (SD)† ‡ | 37 (12) |
| Presence of osteomalacia, n (%) | 11 (78.6) |
| Bowing of the upper, lower, or both extremities, n (%) | 14 (100) |
| Radiographic evidence of a healed fracture, n (%) | 6 (43.0) |
| Active pseudofractures, n (%) | 4 (29.0) |
| Osteoarthritis, n (%) | 8 (57.0) |
| Dental disease, n (%) | 13 (93.0) |
| Prior orthopaedic surgery, n (%) | 11 (79.0) |
| Prior conventional therapy (≥2 years before enrolment) | |
| Oral phosphate salts and active vitamin D metabolites, n (%) | 12 (86.0) |
| Active vitamin D metabolites alone, n (%) | 1 (7.1) |
| No conventional therapy, n (%) | 1 (7.1) |
Adapted from Insogna KL, et al, 20193
†정상범위: 인산염, 2.5–4.5 mg/dL; 1,25(OH)2 D, 18–72 pg/mL; TmP/GFR, 2.5–4.2 mg/dL.1 ‡n=12.
시험대상자는 대부분 18세 이전에 기존 치료를 받았고, 경구 인산염 및 활성 비타민 D 치료기간은 각각 13년과 15년이었습니다.
크리스비타는 XLH가 있는 성인에서 인산염 항상성을 회복시킵니다.3
크리스비타는 베이스라인부터 48주 동안 혈청 인산염 농도를 증가시켰습니다.3
Mean change in serum phosphate3

Adapted from Insogna KL, et al, 20193
혈청 인산염의 정상범위는 2.5–4.5 mg/dL입니다.
크리스비타는 투여 개시 2주 이후 TmP/GFR을 증가시켰고, TmP/GFR은 48주까지 베이스라인 이상으로 유지되었습니다.3
Mean change in TmP/GFR3

Adapted from Insogna KL, et al, 20193
††TmP/GFR의 정상범위는 2.5–4.5 mg/dL입니다.
크리스비타는 초기에 혈청 1,25(OH)2 D 농도를 증가시켰습니다.3
- 크리스비타 치료 시작 후,® 평균 혈청 1,25(OH)2 D 농도는 1주 및 2주에 가장 높았으며, 4주에 거의 베이스라인 레벨로 감소되었습니다.3
- 20주부터 24주까지 중간 용량에서 그 정도는 훨씬 낮지만 유사한 패턴이 관찰되었습니다.
Mean change in serum 1,25(OH)2 D3
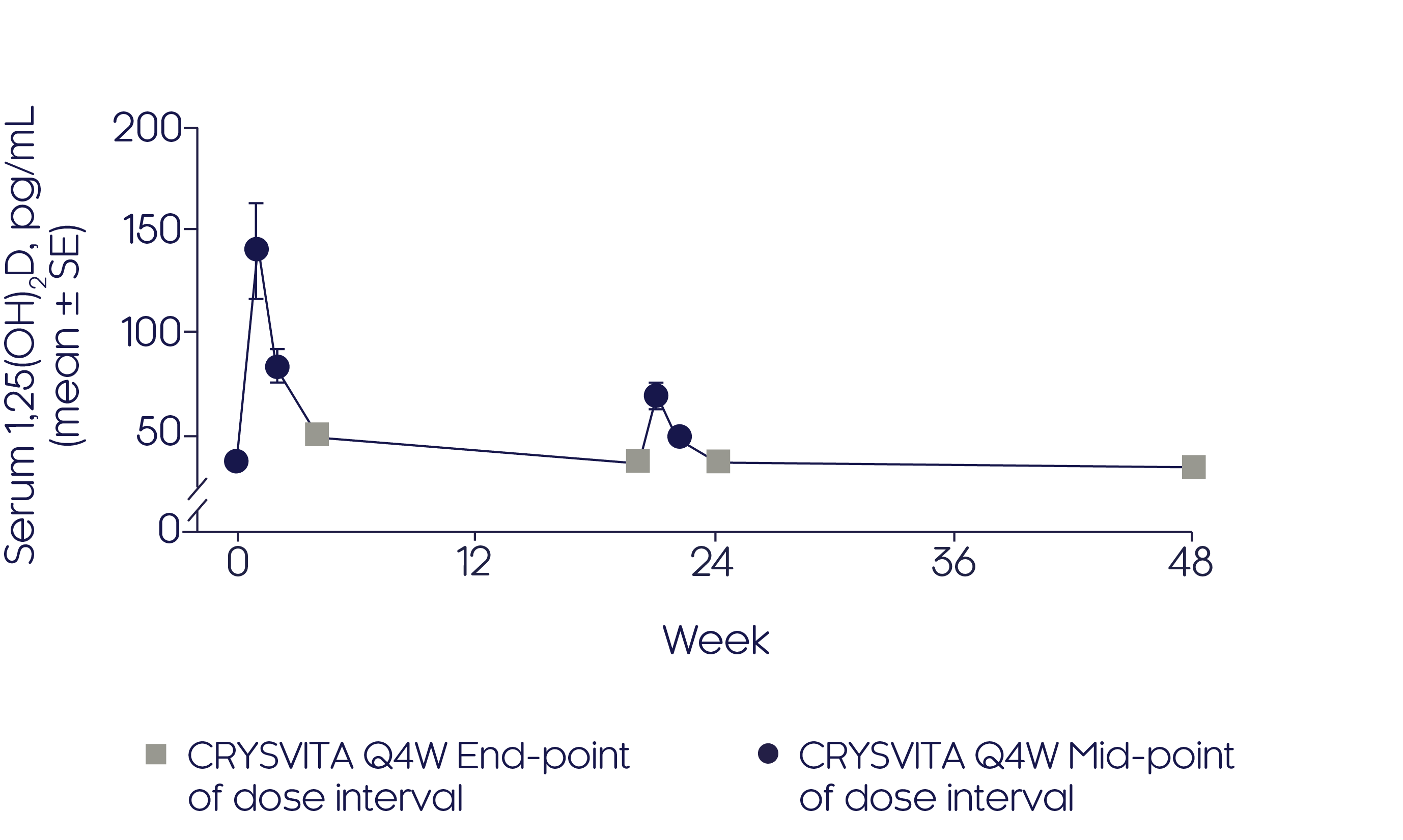
Adapted from Insogna KL, et al, 20193
Phosphate regulation
크리스비타는 성인 XLH 환자에서 통증과 피로를 개선합니다.3
크리스비타는 베이스라인 이후부터 48주까지 BPI 하위점수 감소를 통해 입증된 바와 같이 통증을 개선하였습니다.3
BPI scores
Pain and fatigue
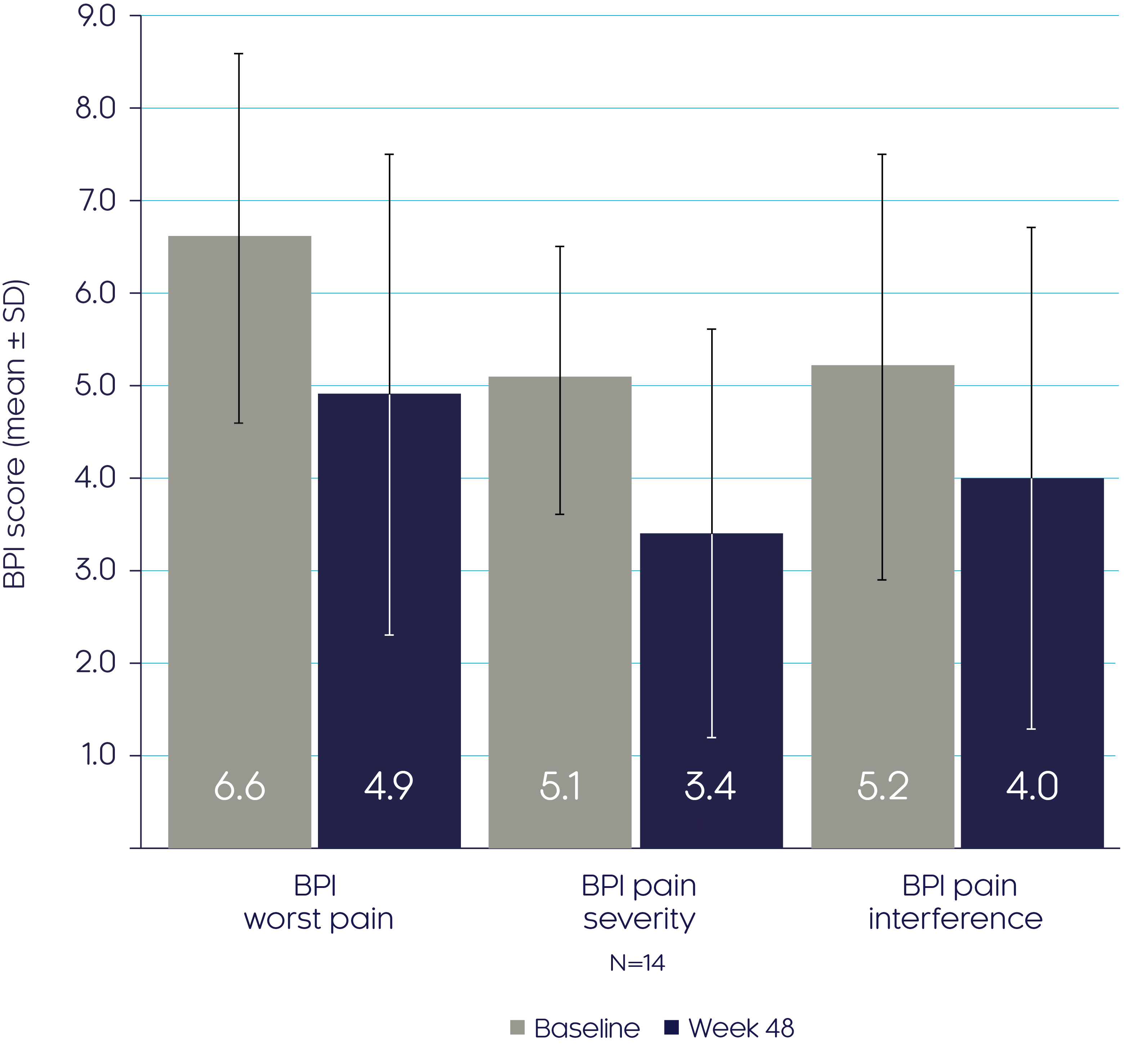
Adapted from Insogna KL, et al, 20193
크리스비타는 베이스라인 이후부터 48주까지 BFI 하위점수 감소로 확인된 바와 같이 피로를 개선하였습니다.3
BFI scores
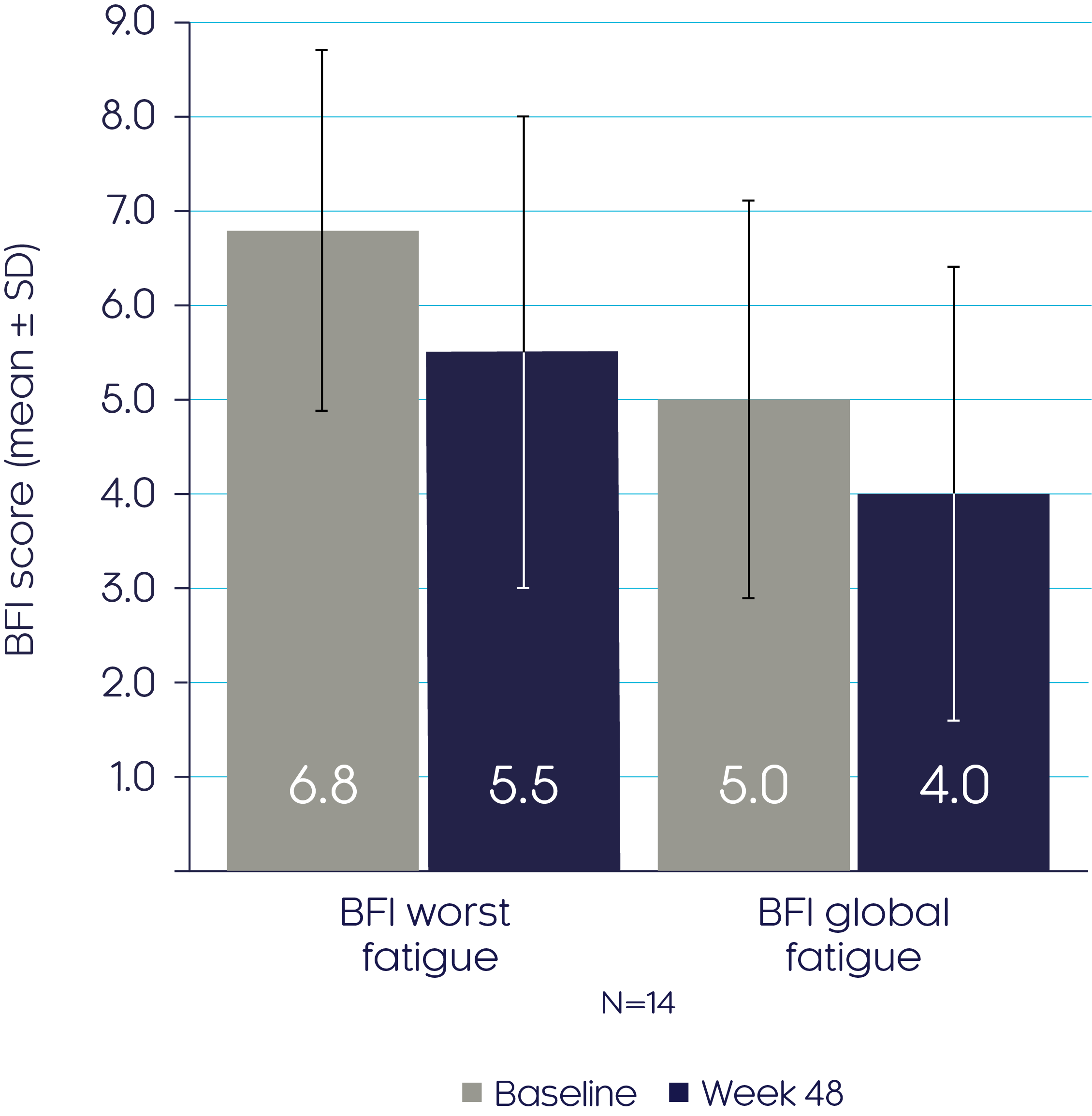
Adapted from Insogna KL, et al, 20193
치료 전/후 얻은 골생검 검체 측정결과는 크리스비타가 XLH가 있는 성인에서 골질을 개선하고 골 무기질화를 향상시킨다는 사실을 보여줍니다.3
Osteomalacia-related histomorphometrics
48주에, 크리스비타는 1차 평가변수인 골질을 개선하였으며, 이는 유골 부피/뼈 부피 및 유골 표면/골표면의 각각 54% (p<0.001) 및 26% (p=0.0002) 평균 감소로 입증되었습니다.3
Osteoid Volume/
Bone Volume3
Osteoid Surface/
Bone Surface3
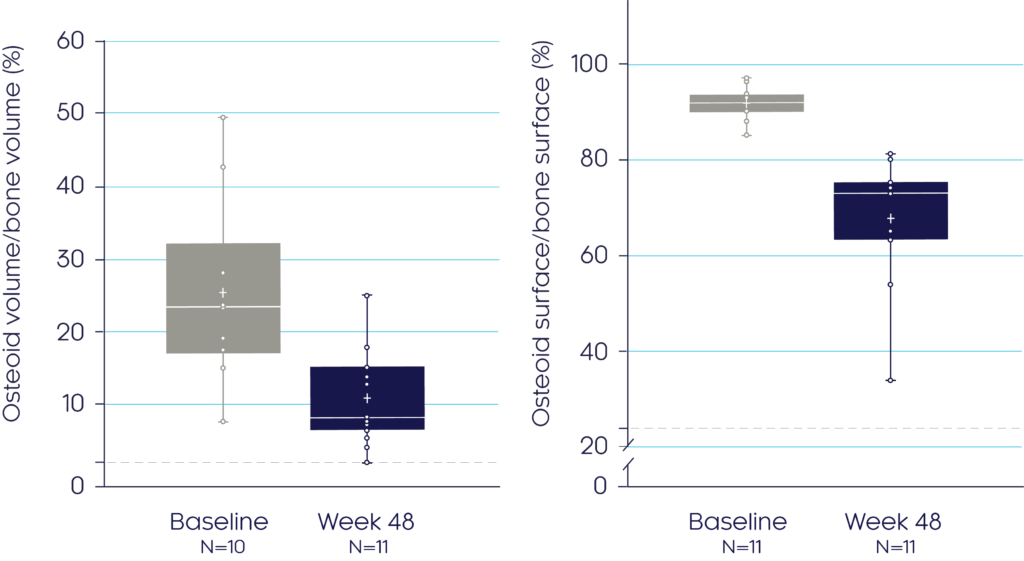
Adapted from Insogna KL, et al, 20193
데이터는 중앙값 (박스 플롯에서 수평선으로 표시됨), 사분위수 및 범위로 제시되어 있습니다.
†파선은 다음에 대한 ULN 기준범위를 나타냅니다: 유골 부피/뼈 부피(3.05%); 유골 표면/골표면(23.9%). 조직형태계측적 평가변수는 양측 t-검정을 사용하여 분석하였습니다. 정규성 가정이 충족되지 않은 경우, 중앙값에 대한 부호 검정을 사용하였습니다.
48주에, 크리스비타는 유골 두께의 32% 평균 감소(p<0.0001)와 무기질화 지체시간 감소(p=ns)로 확인된 바와 같이 무기질화를 향상시켰습니다.3
Pseudofractures
Osteoid thickness3
Mineralisation lag time3
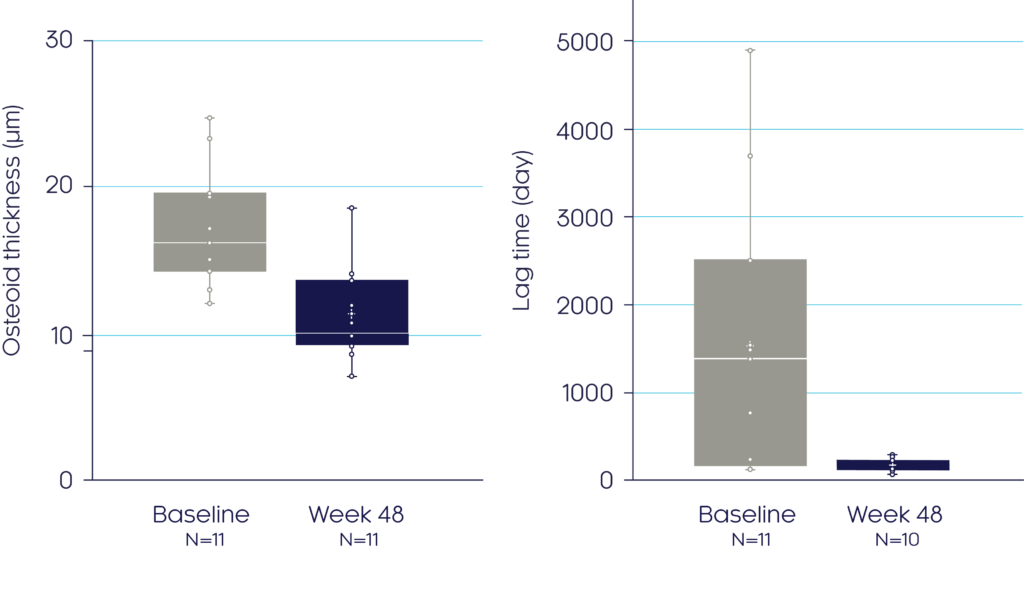
Adapted from Insogna KL, et al, 20193
데이터는 중앙값 (박스 플롯에서 수평선으로 표시됨), 사분위수 및 범위로 제시되어 있습니다.
†파선은 다음에 대한 ULN 기준범위를 나타냅니다: 무기질화 지체시간(28.6일) 및 유골 두께(8.9 μm). 조직형태계측적 평가변수는 양측 t-검정을 사용하여 분석하였습니다. 정규성 가정이 충족되지 않은 경우, 중앙값에 대한 부호 검정을 사용하였습니다.
크리스비타는 가성골절 치유를 나타냅니다.3
Bone remodelling (biochemical and dynamic)
- 12주에, 베이스라인에서 활동성 가성골절이 확인된 4명 중 중 2명은 완전히 치유되었고 2명은 부분 치유되었습니다.3
- 48주에, 베이스라인에서 활동성 가성골절이 확인된 4명 중 3명은 치유되었고, 1명은 방사선사진이 누락됨에 따라 평가가 불가능하였습니다.3
크리스비타는 골 재형성의 생화학적 및 동적 표지자를 개선합니다.3
크리스비타는 48주에 혈청 P1NP와 혈청 CTx 레벨을 증가시켰으며, 이는 골 재형성 및 형성이 개선되었음을 나타냅니다.3
- 크리스비타® 치료는 베이스라인과 비교하여 48주에 P1NP 레벨을 유의하게 증가시켰습니다.3
- LS 평균 증가 77% (LS 평균 ± SE 변화 52.5 ± 11.6 ng/mL; p<0.0001)
- 크리스비타® 치료는 베이스라인과 비교하여 48주에 CTx 레벨을 유의하게 증가시켰습니다.3
- LS 평균 증가 36% (LS 평균 ± SE 변화 175.1 ± 44.0 pg/mL; p<0.0001)
- 크리스비타®치료 시, BALP 최고 레벨은 12주에 확인되었습니다.3
- 12주에, 베이스라인으로부터 LS 평균 증가는 53%였습니다. (LS 평균 ± SE 변화 10.9 ± 3.5 μg/L; 95% CI, 4.0 ~ 17.9)
- 48주에, 베이스라인으로부터 LS 평균 증가는 24%였습니다 (4.5 ± 4.0 μg/L; p=0.26)
크리스비타는 48주에 동적 재형성 파라미터를 개선하였습니다. 3
| UX023-CL3043 |
Healthy adult reference range† Mean ± SD; median (min, max)3 |
||
|---|---|---|---|
| Parameter | n |
Mean ± SD; median (min, max) | |
| Mineral apposition rate (µm/day) | 0.75 ± 0.09; 0.77 (0.57, 0.86) | ||
| Baseline | 11 | 0.58 ± 0.45; 0.43 (0.3, 1.8) | |
| Week 48 | 11 | 0.62 ± 0.19; 0.60 (0.3, 1.0) | |
| MS/BS (%) | 7.9 ± 2.7; 8.3 (3.3, 12.4) | ||
| Baseline | 11 | 6.0 ± 4.8; 3.3 (1.0, 12.9) | |
| Baseline | 11 | 6.0 ± 4.8; 3.3 (1.0, 12.9) | |
| Week 48 | 10 | 7.0 ± 3.7; 5.8 (2.2, 13.6) | |
| MS/OS (%) | 57.9 ± 13.8; 59.2 (39.9, 74.9) | ||
| Baseline | 11 | 6.5 ± 5.1; 3.7 (1.1, 13.8) | |
| Week 48 | 10 | 10.8 ± 6.1; 8.1 (4.0, 20.3) | |
Adapted from Insogna KL, et al, 20193
††정상범위(healthy reference range)는 뼈 발달 및 대사 이상과 독립적인 이유로 수술을 받은 17.0 - 22.9세 대상자 8-12명으로부터 얻은 데이터에 근거합니다.
Safety (48 Weeks)
크리스비타는 성인 XLH 환자에서 내약성이 우수하였고 최대 48주까지 허용되는 안전성 프로파일을 나타냈습니다.3
| Category | Incidence for all patients (N=14)† n (%)3 |
|---|---|
| Any TEAE | 14 (100) |
| Related TEAE | 10 (71.4) |
| Injection-site urticaria | 3 (21.4) |
| Abdominal pain | 2 (14.3) |
| Asthenia | 2 (14.3) |
| Injection-site pain | 2 (14.3) |
| Injection-site reaction | 2 (14.3) |
| Serious TEAE | 2 (14.3) |
| Paraesthesia | 1 (7.1) |
| Migraine | 1 (7.1) |
| Category | Incidence for all patients (N=14)† n (%)3 |
|---|---|
| Related serious TEAE | 0 |
| Grade 3 or 4 TEAE | 3 (21.4) |
| Paraesthesia | 1 (7.1) |
| Migraine and arthralgia | 1 (7.1) |
| Uterine haemorrhage | 1 (7.1) |
| TEAE leading to study discontinuation | 0 |
| TEAE leading to treatment discontinuation | 0 |
| TEAE leading to death | 0 |
Adapted from Insogna KL, et al, 20193
†크리스비타 치료를 48주 이상, 84주 이하 동안 받은 환자.
1. Insogna KL, et al. J Bone Miner Res. 2018;33:1383–93. 2. Portale AA, et al. Calcif Tissue Int. 2019;105:271–84. 3. Insogna KL, et al. J Bone Miner Res. 2019;34:2183–91.






