크리스비타는 소아 XLH 환자에서 인산염 레벨, 구루병 중증도 및 이동성을 유의하게 개선하는 것으로 입증되었습니다.1,3
Table of Contents
Phase II efficacy and safety
1-4세 소아 XLH 환자를 대상으로 한 크리스비타의 유효성 및 안전성은 2상 임상시험에서
연구되었습니다.2
시험 디자인2
오픈라벨, 2상 임상시험 베이스라인에서 베이스라인에서 연령이 1-4세인 소아 XLH 환자 13명에서 크리스비타의® 유효성과 안전성을 조사하기 위해 3개 기관에서 수행되었습니다. 시험 기간은 64주였고 시험대상자는 연장 기간 동안 추가로 최대 96주까지 크리스비타를® 계속 투여받을 수 있었습니다.

†크리스비타® 용법용량:64주 동안 0.8mg/kg을 2주에 1회 투여하였습니다. 2회 연속 투여 전 혈청 인산염 농도가 1.03 mmol/L 미만이고, 혈청 인산염이 베이스라인 대비 0.16 mmol/L 미만으로 증가했으며, 크리스비타® 투여를 누락하지 않은 경우, 용량을 1.2 mg/kg으로 증량하였습니다.
공동 1차 평가변수2
- 베이스라인 대비 40주에 혈청 인산염 농도의 변화
- 안전성
2차 평가변수2
- 베이스라인 대비 40주와 64주에 RGI-C의 변화
- 생화학적 : 베이스라인 대비 ALP 및 혈청 1,25(OH)2D
- 누워서 측정한 키 또는 서서 측정한 키의 변화
주요 결과2
- 크리스비타는 공복 혈청 인산염 농도를 정상 범위 내로 증가시켰고, 이는 시험 기간 동안 지속되었습니다.
- 크리스비타® 치료 시, 모든 환자가 40주차에 구루병의 상당한 치유와 긍정적인 하지 변형 점수를 얻었습니다.
- 치료 이득은 64주까지 지속되었고 또 다른 2상 시험(5-12세 소아XLH 대상) 에서 크리스비타® 치료 시 확인된 개선과 일치하였습니다.1
- 크리스비타® increased serum 1,25(OH)2 D
- 크리스비타는 허용되는 안전성 프로파일을 나타냈습니다.
크리스비타 0.8 mg/kg 로 투여를 시작한 1~4세 소아 XLH 환자는
인산염 항상성이 회복되고 구루병이 유의하게 개선됩니다.2
Phase III efficacy and safety
5~12세 소아 XLH 환자를 대상으로 한 크리스비타의® 유효성 및 안전성은 2상 임상시험에서 연구되었습니다.1
시험 디자인1
5-12세 소아 XLH 환자 52명을 대상으로 크리스비타의 유효성과 안전성을 조사하기 위해 9개 기관에서 수행하였습니다. 무작위배정, 오픈라벨, 평행군, 2상 임상시험으로, 시험기간은 64주였고 환자들은 연장 기간에 등록할수 있는 기회를 제공받았습니다.

†크리스비타 용법용량: 2주 1회 0.1 mg/kg 또는 4주 1회 0.2 mg/kg으로 시작하였습니다. 중증의 부작용이 관찰되지 않은 경우, 환자들은 이후 2주 1회 0.2mg/kg 또는 0.3 mg/kg, 또는 4주 1회 0.4mg/kg 또는 0.6 mg/kg으로 증량된 용량을 투여받도록 배정되었습니다.
1차 평가변수1
- 베이스라인 대비 40주와 64주에 RSS 총점의 변화
2차 평가변수1
- 베이스라인 대비 40주와 64주에 RGI-C의 변화
- 생화학적 : 베이스라인 대비 혈청 인산염, TmP/GFR, 혈청 1,25(OH)2 D, ALP 변화
- 성장 속도와 신장 Z 점수 변화
- 안전성
주요 결과1
- 크리스비타® 치료는 혈청 인산염 레벨을 정상 범위 내로 증가시켰습니다.
- 2주 1회 크리스비타 투여 시, 용량 조정 후 혈청 인산염 수치는 정상 또는 거의 정상 수준으로 지속적으로 증가했습니다.
- 크리스비타® administered every 4 weeks was associated with lower levels of serum phosphate at the end of each dose interval
- 인산염 항상성의 개선은 구루병 중증도 감소에 해당됩니다.
- 이는 성장과 신체 활동의 동시 개선과 통증 감소에 기여합니다.
- 크리스비타는 하지 기형을 작지만 유의하게 감소시켜 RGI-C 점수를 개선하였습니다.
- 시험 중단, 치료 중단 또는 사망을 초래한 이상사례는 발생하지 않았습니다.
- 다른 모든 TEAEs는 경증 또는 중등증이었습니다.
크리스비타 치료는 이전에 기존 치료법으로 임상적 개선이 제한적인 XLH가 있는 5-12세
소아에서 인산염 항상성을 회복시키고 구루병을 개선함으로써 치료 효과를 제공합니다.1
2상 임상시험으로부터 긍정적인 결과를 확인한 후1 , 1-12세 소아에서 기존 치료와 비교하여 크리스비타의 유효성과 안전성을 조사하기 위해 3상 임상시험을 수행하였습니다.3
소아 XLH 환자를 대상으로 크리스비타의 유효성과 안전성은 3상 임상시험에서
연구되었습니다.3
시험 디자인3
A randomised, active-controlled, open-label, phase III trial at 16 clinical sites, compared the efficacy and safety of CRYSVITA® with conventional therapy in children with XLH aged 1—12 years, over a 64-week period.3
| Study population | |
|---|---|
| Children with XLH, aged 1—12 years old | N=61 |
| 공복 혈청 인산염 (Fasting serum phosphate) <0.97 mmol/L (3.0 mg/dL) | Confirmed PHEX mutation or variant of unknown significance in the patient or a family member |
Prior conventional therapy
| Total RSS ≥2.0 |

†크리스비타® 용량용법: SC 0.8 mg/kg Q2W용량으로 시작하였습니다. 2회 연속 투여 전 공복 혈청 인산염 농도가 <1.03 mmol/L (3.2 mg/dL)이고 혈청 인산염 농도가 1회 측정에서 베이스라인으로부터 <0.16 mmol/L (<0.5 mg/dL)로 증가된 경우 1.2 mg/kg Q2W로 증량하였습니다.
‡‡기존 치료 용법용량: 소아에서 권장되는 경구 인산염 용량은 20–60 mg/kg/day을 하루 3-5회 나누어 투여하거나 알파칼시돌은 40–60 ng/kg/day 또는 칼시트리올은 20–30 ng/kg/day였습니다. 활성 비타민 D는 제제에 따라 하루에 1-3회 투여받을 수 있었습니다.
§§누워서 측정한 키/서서 측정한 키 Z 점수와 하지 변형 점수에 대한 1차 평가는 64주에 실시합니다.
1차 평가변수3
- 40주에 RGI-C Global 점수로 평가한 구루병 중증도의 베이스라인으로부터 변화
2차 평가변수3
- 64주에 RGI-C Global 점수로 평가한 구루병 중증도의 베이스라인으로부터 변화
- 40주와 64주에 평균 RGI-C Global 점수≥+2.0 (상당한 개선)을 나타낸 시험대상자 비율
- 40주와 64주에 Thacher RSS의 베이스라인으로부터 변화
- 40주와 64주에 RGI-C long leg 점수로 평가한 하지 변형의 베이스라인으로부터 변화
- 40주와 64주에 성장 점수의 베이스라인으로부터 변화:
- 신장연령 Z 점수
- 성장 속도
- 24주, 40주, 64주에 6MWT 총 이동거리 및 정상 예측치%(스크리닝 방문에서 5세 이상인 시험대상자의 경우)의 베이스라인으로부터 변화
- 시간 경과에 따른 혈청 인산염의 베이스라인으로부터 변화
- Change from baseline over time in serum 1,25(OH)2D
- 시간 경과에 따른 TmP/GFR 비의 베이스라인으로부터 변화
- 시간 경과에 따른 ALP의 베이스라인으로부터 변화
환자 특성3
| Characteristic | Conventional therapy (n=32) | 크리스비타® SC Q2W (n=29) |
|---|---|---|
| Age, years, mean (SD) | 6.3 (3.2) | 5.8 (3.4) |
| Girls, n (%) | 18 (56%) | 16 (55%) |
| Boys, n (%) | 14 (44%) | 13 (45%) |
| White, n (%) | 25 (78.1%) | 25 (86.2%) |
| Height Z score, Mean (SD)Median [Range] | –2.1 (0.9) –2.1 [–2.51 to –1.44] | –2.3 (1.2) –2.3 [–3.05 to –1.45] |
| Weight Z score, Mean (SD)Median [Range] | –0.6 (0.9) –0.7 [-1.17 to 0.05] | –0.9 (1.2) –0.8 [-1.75 to 0.59] |
| Tanner stage, n(%) | ||
| 1 | 31 (97%) | 27 (93%) |
| 2 | 1 (3%) | 2 (7%) |
| Serum phosphate, mmol/L, mean (SD) | 0.74 (0.08) | 0.78 (0.08) |
| Serum TmP/GFR, mmol/L, mean (SD) | 0.65 (0.11) | 0.71 (0.12) |
| Serum 1,25(OH)2D, pmol/L, mean (SD) | 96 (36) | 110 (48) |
| Serum 25(OH)D, nmol/L, mean (SD) | 79.38 (25.14) | 80.63 (26.15) |
| ALP, U/L, mean (SD) | 523.4 (154.4) | 510.8 (124.9) |
| Duration of conventional therapy, years, mean (SD) Median [min, max] |
4.3 (3.0) 3.5 [1.88, 6.33] |
3.3 (3.1) 2.2 [1.56, 3.47] |
| Total Thacher RSS, mean (SD) Median [range] |
3.2 (1.1) 3.0 [2.50, 4.00] |
3.2 (1.0) 3.0 [2.50, 3.50] |
베이스라인 값은 환자들이 기존 치료를 중단하고 7일간의 휴약기 이후 평가하였습니다.
Phosphate regulation
크리스비타 치료는® 소아 XLH환자들의 성장지연을 예방합니다.3
크리스비타® 료는 기존 치료와 비교하여 2주차부터 빠르게 평균 혈청 인산염 레벨을 상당히 개선하였으며, 이는 64주동안 유지되었습니다.3
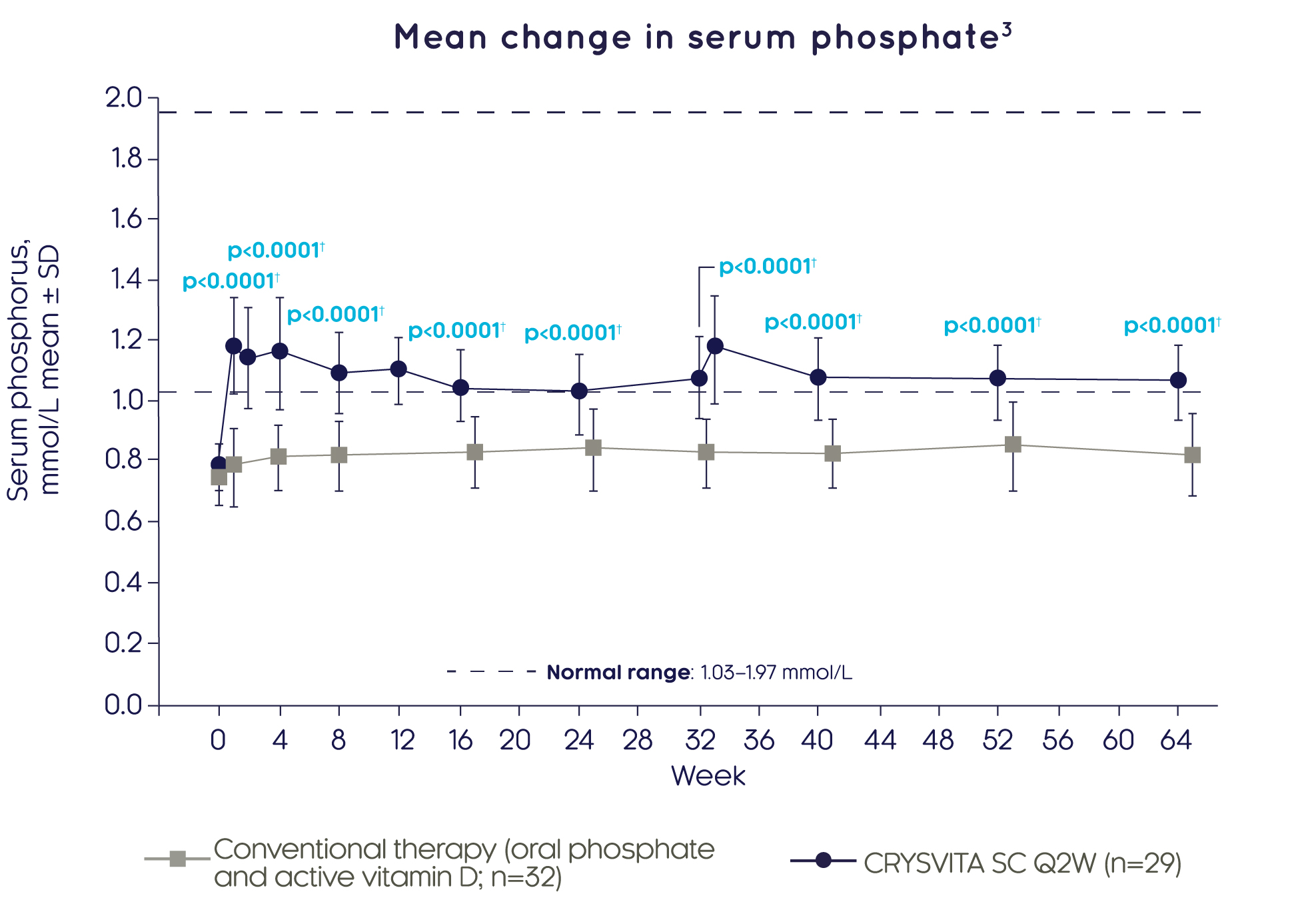
Adapted from Imel EA, et al. 20193
††GEE 모델을 이용한 베이스라인으로부터 LS 평균 변화에 대한 치료군 간 비교 결과에 근거함.
2주, 12주 및 33주차의 평가는 크리스비타® 치료군에서만 수행되었습니다. 베이스라인 후 값은 오차 막대 겹침을 피하기 위해 오프셋됩니다.
크리스비타® achieved significantly greater increases in serum 1,25(OH)2D compared with conventional therapy over 64 weeks3
Adapted from Imel EA, et al. 20193
††GEE 모델을 이용한 베이스라인으로부터 LS 평균 변화에 대한 치료군 간 비교 결과에 근거함.
Bone health
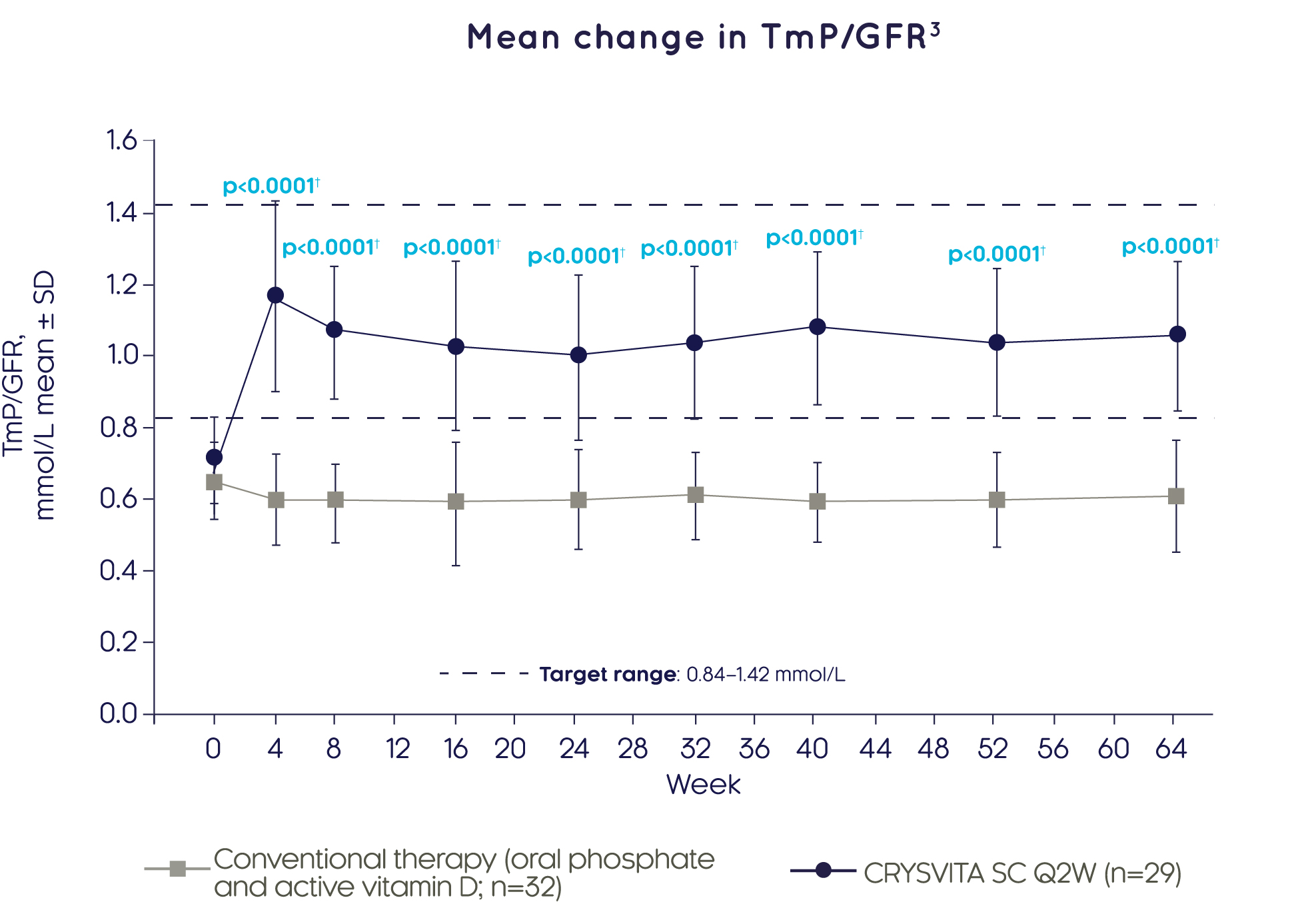
크리스비타® improves biochemical markers of bone health3
크리스비타® 기존 치료와 비교하여 4주차에 빠르게 신장에서 인산염 재흡수(TmP/GFR 평가)를 유의하게 더 큰 폭으로 개선하였고, 이는 64주 동안 지속되었습니다.3

Adapted from Imel EA, et al. 20193
††GEE 모델을 이용한 베이스라인으로부터 LS 평균 변화에 대한 치료군 간 비교 결과에 근거함. 일부 베이스라인 후 값은 오차 막대 겹침을 피하기 위해 실제 치료주로부터 오프셋됩니다.
‡‡정상범위는 1-15세 남아와 여아에서 성별과 연령에 따라 달라집니다. 상한값은 297 ~ 385 U/L 범위에 해당되었습니다.
Rickets
크리스비타® 뼈 건강의 생화학적 지표를 개선합니다.3
크리스비타® 기존 치료와 비교하여 64주 동안 ALP 활성을 유의하게 큰 폭으로 감소시켰습니다.3

Adapted from Imel EA, et al. 20193
††40주에는 ANCOVA 모델을 사용하고 64주에는 GEE 모델을 사용하여 LS 평균 변화의 치료군 간 비교 결과에 근거함.
크리스비타® 크리스비타로 치료한 소아환자는 기존 치료 대비 더 높은 비율로 구루병의 상당한 개선 또는 완전한 치료(RGI-C 점수 ≥2.0)를 달성하였습니다.(크리스비타군 87% vs 기존 치료군 19%)3

††GEE 모델에는 치료, 방문, 치료군과 방문 간 상호작용과 베이스라인 연령 층화가 요인으로 포함되며 베이스라인 RSS 총점이 연속형 공변량으로 포함됩니다.
크리스비타® 40주와 64주에 기존 치료와 비교하여 Thacher RSS 총점을 유의하게 더 큰폭으로 개선하였습니다.3
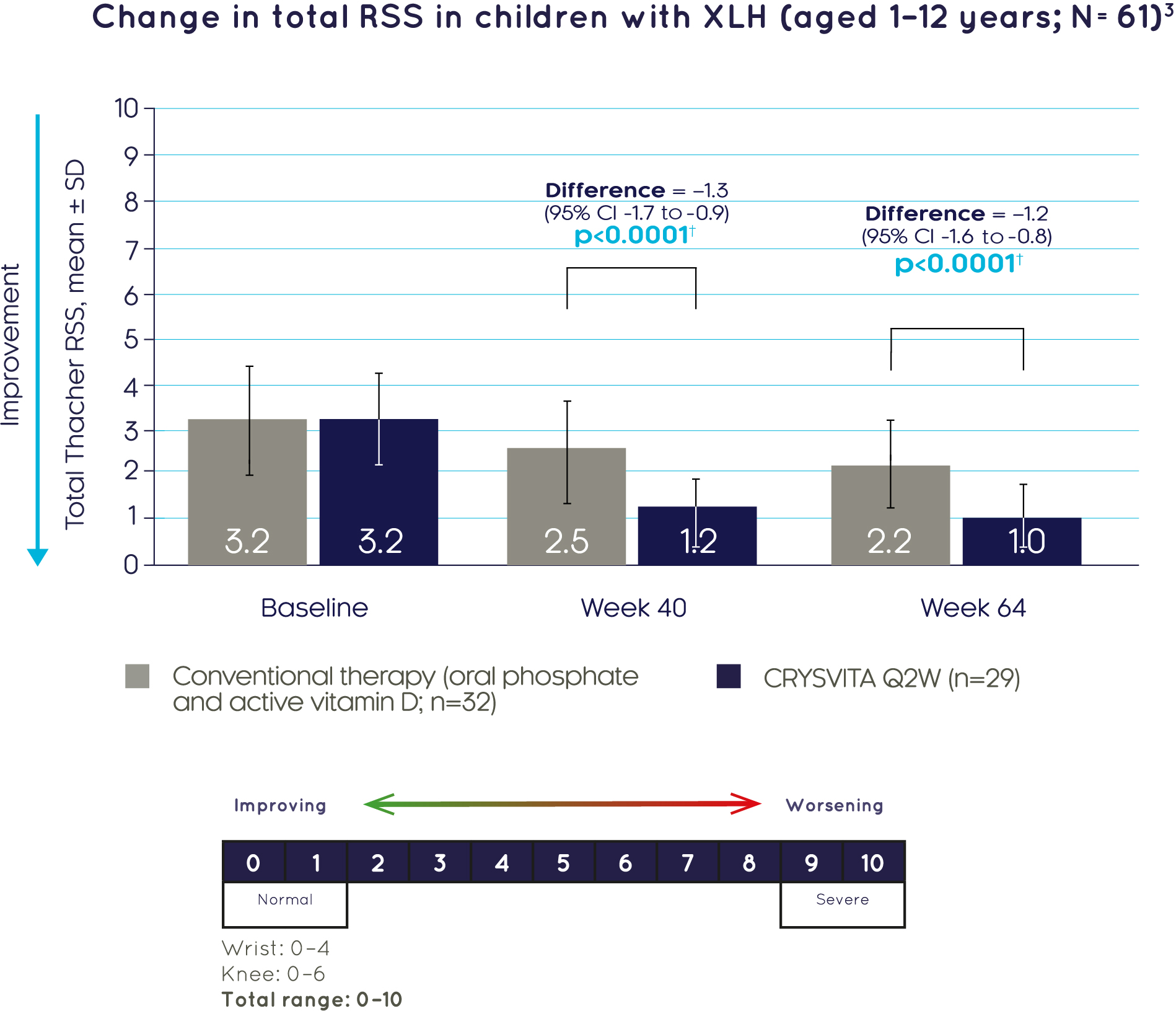
††40주에는 ANCOVA 모델을 사용하고 64주에는 GEE 모델을 사용하여 LS 평균 변화의 치료군 간 비교 결과에 근거함.
크리스비타로 치료받은 4세 여아 XLH 환자의구루병 개선®3

| Score | Baseline | Week 40 |
|---|---|---|
| Thacher RSS | ||
| Wrist | 2.0 | 0.5 |
| Knee | 1.5 | 1.0 |
| Total | 3.5 | 1.5 |
| RGI-C score† | ||
| Wrist | - | +2.3 |
| Knee | - | +2.0 |
| Global | - | +2.0 |
†Substantial healing is defined as an RGI-C score ≥+2.0.
Lower limb deformity
크리스비타® helps correct lower leg deformity in children with XLH3
크리스비타® 40주와 64주에 기존 치료와 비교하여 유의하게 더 높은 RGI-C 하지 변형 점수를 나타냈습니다.3

Adapted from Imel EA, et al. 20193
††GEE 모델을 이용한 베이스라인으로부터 LS 평균 변화의 치료군 간 비교 결과에 근거함.
Growth
크리스비타® prevents early decline in growth in children with XLH3
크리스비타® 40주와 64주에 기존 치료와 비교하여 누워서 측정한 키/서서 측정한 키 Z 점수를 유의하게 더 큰 폭으로 개선하였습니다.3

Adapted from Imel EA, et al. 20193
††누워서 측정한 키/서서 측정한 키 Z 점수에 대해 GEE 모델을 사용하고 성장 속도 Z 점수에 대해 ANCOVA 모델을 사용하여 베이스라인으로부터 LS 평균 변화의 치료군 간 비교 결과에 근거함. 일부 베이스라인 후 값은 오차 막대 겹침을 피하기 위해 실제 치료주로부터 오프셋됩니다.
크리스비타® 64주에 기존 치료와 비교하여 평균 성장 속도 Z 점수를 유의하게 더 큰 폭으로 개선하였습니다.3

††누워서 측정한 키/서서 측정한 키 Z 점수에 대해 GEE 모델을 사용하여 성장 속도 Z 점수에 대해 ANCOVA 모델을 사용하여 베이스라인으로부터 LS 평균 변화의 치료군 간 비교 결과에 근거함.
Mobility
크리스비타® 소아 XLH가 환자의이동성을 개선합니다.3
크리스비타® 4주에 기존 치료와 비교하여 6MWT에서 보행거리 예측치%를 유의하게 더 큰 폭으로 증가시켰습니다.3
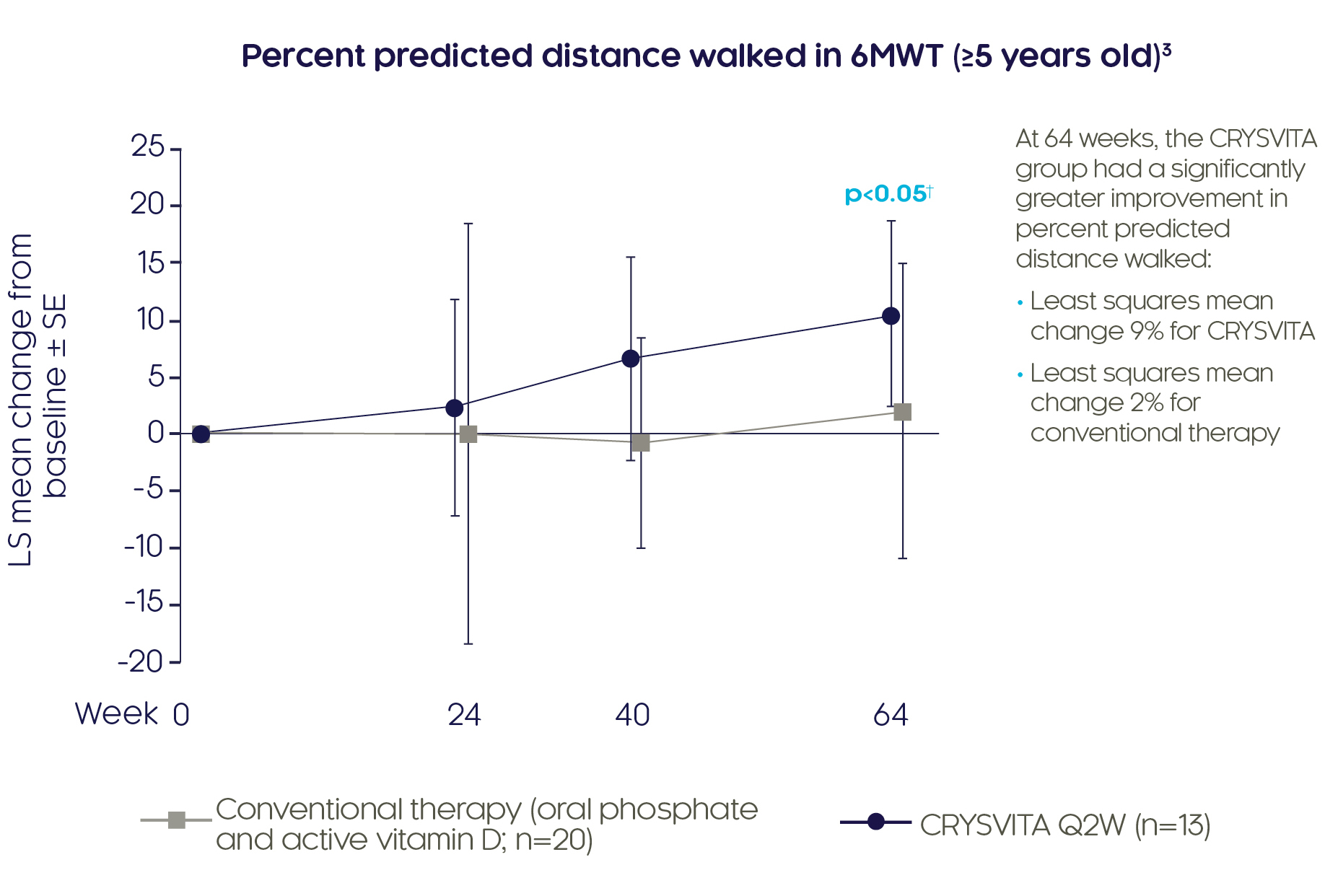
Adapted from Imel EA, et al. 20193
†GEE 모델을 이용한 베이스라인으로부터 LS 평균 변화에 대한 치료군 간 비교 결과에 근거함.
6MWT는 검사를 수행할 수 있는 5세 이상 환자에서 평가하였습니다. 일부 베이스라인 후 값은 오차 막대 겹침을 피하기 위해 실제 치료주로부터 오프셋됩니다.
안전성
최대 64주까지 XLH가 있는 소아에서 보고된 가장 흔한 이상반응† (TEAEs;treatment-emergent adverse events)†3
| 평가 항목 | Conventional therapy (n=32) n (%) | 크리스비타® SC Q2W (n=29) n (%) |
|---|---|---|
| Pyrexia | 6 (19%) | 16 (55%) |
| Cough | 6 (19%) | 15 (52%) |
| Arthralgia | 10 (31%) | 13 (45%) |
| Vomiting | 8 (25%) | 12 (41%) |
| Nasopharyngitis | 14 (44%) | 11 (38%) |
| Pain in extremity | 10 (31%) | 11 (38%) |
| Headache | 6 (19%) | 10 (34%) |
| Injection site erythema | 0 | 9 (31%) |
| Dental caries | 2 (6%) | 9 (31%) |
| Tooth abscess | 3 (9%) | 8 (28%) |
| Injection site reaction‡ | 0 | 7 (24%) |
| Rhinorrhoea | 2 (6%) | 7 (24%) |
| Diarrhoea | 2 (6%) | 7 (24%) |
| Vitamin D decrease | 1 (3%) | 6 (21%) |
| Constipation | 0 | 5 (17%) |
†Adverse reactions in the frequency category of ‘very common’ (≥1/10); ‡Injection site reaction is a grouped term that includes injection site reaction, erythema, pruritus, rash, erosion, swelling, urticaria, discomfort, hypersensitivity, inflammation and papule. Please refer to the full 크리스비타 제품설명서를 and publication3 for details on full safety profile of CRYSVITA®
1. Carpenter TO, et al. N Engl J Med. 2018;378:1987–98. 2. Whyte MP, et al. Lancet Diabetes Endocrinol. 2019;7:189–99. 3. Imel EA, et al. Lancet. 2019;393:2416–27.






