관련 자료
다운로드 가능한 자료
크리스비타® 관련 자료
XLH 관련 자료
심포지엄 하이라이트
Videos
관련 논문
- Portale AA, et al. Continued beneficial effects of burosumab in adults with X-linked hypophosphatemia: Results from a 24-week treatment continuation period after a 24-week double-blind placebo-controlled period. Calcif Tissue Int. 2019;105:271–84.
PubMed link: https://pubmed.ncbi.nlm.nih.gov/31165191/ - Insogna KL, et al. Burosumab improved histomorphometric measures of osteomalacia in adults with X-linked hypophosphatemia: A phase 3, single-arm, international trial. J Bone Miner Res. 2019;34:2183–91
PubMed link: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6916280/ - Haffner D, et al. Clinical practice recommendations for the diagnosis and management of X-linked hypophosphataemia. Nat Rev Nephrol. 2019;15:435-55.
PubMed link: https://www.ncbi.nlm.nih.gov/pubmed/31068690 - Imel EA, et al. Burosumab versus conventional therapy in children with X-linked hypophosphataemia: a randomised, active-controlled, open-label, phase 3 trial. Lancet. 2019;393:2416-27.
PubMed link: https://www.ncbi.nlm.nih.gov/pubmed/31104833 - Whyte MP, et al. Efficacy and safety of burosumab in children aged 1–4 years with X-linked hypophosphataemia: a multicentre, open-label, phase 2 trial. Lancet Diabetes Endocrinol. 2019;7:189-99.
PubMed link: https://www.ncbi.nlm.nih.gov/pubmed/30638856 - Beck-Nielsen SS, et al. FGF23 and its role in X-linked hypophosphatemia-related morbidity. Orphanet J Rare Dis. 2019;14:58.
PubMed link: https://www.ncbi.nlm.nih.gov/pubmed/30808384 - Insogna KL, et al. A randomized, double-blind, placebo-controlled, phase 3 trial evaluating the efficacy of burosumab, an anti-FGF23 antibody, in adults with X-linked hypophosphatemia: Week 24 primary analysis. J Bone Miner Res. 2018;33:1383-93.
PubMed link: https://pubmed.ncbi.nlm.nih.gov/29947083/ - Carpenter TO, et al. Burosumab therapy in children with X-linked hypophosphatemia. N Engl J Med. 2018;378:1987-98.
PubMed link: https://www.ncbi.nlm.nih.gov/pubmed/29791829
크리스비타/XLH 주요 내용
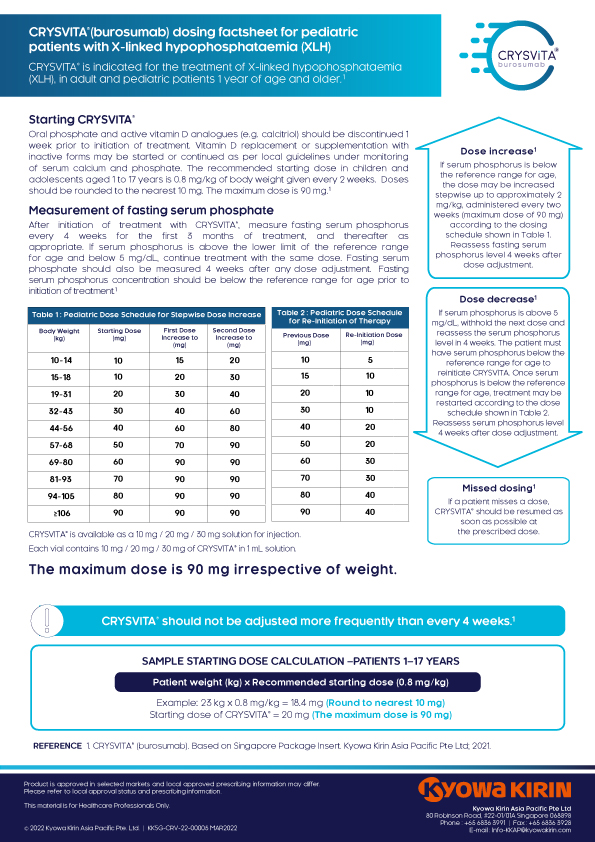
크리스비타/XLH Factsheet®
XLH
XLH란 무엇인가요?
XLH는 드물게 발생하는 유전성*, 진행성, 일생 동안 지속되는 인산 소실 질환이며, FGF23 과잉을 초래하는 PHEX 유전자에 생긴 돌연변이에 의해 발생됩니다.1–4
What is the prevalence of XLH?
XLH는 인구 20,000명 또는 60,000명당 1명 꼴로 발 생합니다.1,5

How is XLH inherited?
XLH는 X 염색체 우성 형식으로 유전됩니다. 그러나, 환자의 20-30%는 자연발생 돌연변이로 인해 발생 됩니다6,7
What is XLH caused by?
XLH는 X 염색체 에 위치한 PHEX gene4,5유전자의 돌연변이가 원인이 되어 발생합니다.
What does it mean for patients with XLH?
XLH에서 FGF23 레벨이 과잉 상태이면
- 신장에서 인산염 재흡가 감소하고, 소변을 통한 인산염 배설이 증가합니다.8
- 활성 비타민 D (1,25[OH]2D) 생성이 감소하고, 장내 인산염 흡수가 감소합니다. 8
이는 만성 저인산혈증을 유발하여 뼈의 미네랄화를 손상시키고, 환자의 신체 기능과 삶의 질에 영향을 주는 다양한 임상적 징후를 초래합니다.9
XLH는 단순한 뼈의 질환이 아니라 근육 및 치아에도 영향을 미치는 다기관 질환입 니다.4,10
크리스비타®
크리스비타란 무엇인가요® ?
크리스비타는 과잉 FGF23에 결합하여 그 활성을 억제하는 유전자재조합 완전 인간 단일클론 항체 IgG1입니다.11 크리스비타는 XLH의 병태생리학적 특성을 표적으로 하는 최초의 유일한 질병조절 생물학적 치료제입니다.11
크리스비타는 어떻게
작용하나요?
크리스비타는 과잉 FGF23® 활성을 억제함으로써, XLH 환자에서 인산염 항상성을 회복시키고 골 무기질화, 이동성 및 통증을 개선시킵니다.11-14
누가 크리스비타를 투여받을 수 있나요®?
크리스비타는 FGF23관련 저인산혈증성 구루병 및 골연화증이 있는 환자에 사용하도록 허가를 받았습니다. 11 (급여 조건은 다를 수 있으니 급여 고시를 확인하시기 바랍니다.) 11
왜 크리스비타를 사용해야 하나요®?
크리스비타의® 유효성과 안전성은 1~12세 소아 및 성인 XLH 환자를 대상으로 글로벌 임상개발 프로그램에서 연구되었습니다.12–16
소아 XLH 환자에 대한 3상 임상시험에서, 기존 치료법에서 크리스비타로 치료를 전환한 환자는 기존 치료법을 계속 유지한 군과 비교하여 다음과 같은 결과가 확인되었습니다:®13:
- 인산염 항상성이 개선되었습니다.
- 64주까지 구루병 치유가 유의하게 개선되고 구루병의 중증도가 감소되었습니다.
- 64주까지 성장과 이동성 결과가 유의하게 개선되었습니다.
- 64주까지 인산염 조절 및 뼈 건강의 생화학적 지표가 유의하게 개선되었습니다.
- 이 3상 임상시험에서, 크리스비타는 소아 XLH 환자는 64주 동안 허용되는 수준의 안전성 프로파일을 나타냈습니다.13
성인 XLH 환자에 대한 3상 임상시험에서는
- 이중 맹검 위약 대조 시험(double-blind placebo-controlled study) 에서 위약 그룹에 비해 크리스비타® 그룹에서 인산염 항상성, 골절 치유, 골 무기질화 및 재형성(remodeling)이 개선되었고, 경직(stiffness)이16
- Sigle-arm study에서 베이스라인 대비 크리스비타로® 치료받은 환자군은 48주까지 인산염 항상성이 개선되었고, 골질, 골 무기질화 및 재형성이 증가되었습니다.14
- Open-label study에서 48주에 크리스비타로 지속 치료 받은 군이 위약 투여 후 크리스비타를® 투여받은 환자와 비교하여 (Baseline에서 발견된) 골절 및 가성골절이 치료된 비율이 더 높았습니다.® after placebo at Week 48 in an open-label study.12
- 위약으로 치료받던 환자가 24주에 크리스비타® 치료를 시작한 경우 48주차에 (Baseline에서 발견된) 골절 및 가성골절의 치료는 시험 시작부터 크리스비타® 치료를 받은 환자의 24주 치료 결과와 유사하였습니다.12
- 크리스비타 치료는 이중 맹검 위약 대조 시험(double-blind placebo-controlled study)에서 위약 그룹 대비 48주차에 통증, 경직 및 신체 기능과 이동성의 지속적인 개선을 나타냈습니다.12
- 이러한 3상 시험에서, 크리스비타는® 성인 XLH환자에서 최대 48주까지 허용되는 안전성 프로파일을 나타냈습니다.12,14
관련 웹사이트
Publicly Available Websites
XLH 정보 사이트 (보건의료전문가용)

1. XLHLink.asia (Healthcare professional website)
https://www.xlhlink.asia/hcp/
이 웹사이트는 Kyowa Kirin Asia Pacific Pte. Ltd.에 의해 운영됩니다
XLH 정보 사이트 (환자용)

1. XLHLink.asia (Patient website)
https://www.xlhlink.asia/
이 웹사이트는 Kyowa Kirin Asia Pacific Pte. Ltd.에 의해 운영됩니다
XLH 환자 단체 (XLH를 앓고 있는 환자들을 위한 모임)

1. Rare Disorder Society Singapore (RDSS)
RDSS was established in 2011 and aims to engage individuals and organizations, both private and public, to raise awareness on rare disorders and how we can all do a part to help patients living with rare disorders. The RDSS leadership team consists of members of the public with medical doctors acting as medical advisors.
https://www.rdss.org.sg
1. Beck-Nielsen SS, et al. Eur J Endocrinol. 2009;160:491–7. 2. Endo I, et al. Endocr J. 2015;62:811–6. 3. Carpenter TO, et al. J Bone Miner Res. 2011;26:1381–8. 4. Haffner D, et al. Nat Rev Nephrol. 2019;15:435–55. 5. Rafaelsen S, et al. Eur J Endocrinol. 2016;174:125–36. 6. Rajah J, et al. Eur J Pediatr. 2011;170:1089–96. 7. Raimann A, et al. Wien Med Wochenschr. 2020;170:116–23. 8. Razzaque MS. Nat Rev Endocrinol. 2009;5:611–9. 9. Linglart A, et al. Endocr Connect. 2014;3:R13–30. 10. Beck-Nielsen SS, et al. Orphanet J Rare Dis. 2019;14:58. 11. CRYSVITA® (burosumab). Based on Singapore Package Insert. Kyowa Kirin Asia Pacific Pte Ltd; May 2021. 12. Portale AA, et al. Calcif Tissue Int. 2019;105:271–84. 13. Imel EA, et al. Lancet. 2019;393:2416–27. 14. Insogna KL, et al. J Bone Miner Res. 2019;34:2183–91. 15. Carpenter TO, et al. N Eng J Med. 2018;378:1987–98. 16. Insogna KL, et al. J Bone Miner Res. 2018;33:1383–93